Keratin (hebrew)
From Proteopedia
| (16 intermediate revisions not shown.) | |||
| Line 6: | Line 6: | ||
]] | ]] | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | קרטינים הם קבוצה של חלבונים מבניים המאורגנים במבנה של סיבים, הנקראים סיבי ביניים (intermediate filaments). | + | קרטינים הם קבוצה של חלבונים מבניים המאורגנים במבנה של סיבים, הנקראים סיבי ביניים (intermediate filaments). מוכרים עשרות חלבוני קרטין, הממוספרים במספרים שונים. <br> |
| - | <br> | + | הקרטינים מתחלקים לשתי קבוצות: קרטין α - מרכיב את העור, השיער, הצמר, הקרניים, הציפורניים והפרסות של יונקים, וקרטין β - הקשה יותר מקרטין α ומרכיב את הקשקשים והציפורניים של זוחלים, שריוני צבים, וכן את הנוצות והמקור אצל עופות.<br> |
| - | הקרטינים מתחלקים לשתי קבוצות: קרטין α - מרכיב את העור, השיער, הצמר, הקרניים, הציפורניים והפרסות של יונקים, וקרטין β - הקשה יותר מקרטין α ומרכיב את הקשקשים והציפורניים של זוחלים, שריוני צבים, וכן את הנוצות והמקור אצל עופות. | + | |
| - | הקרטינים חיוניים לתמיכה מבנית בתא ולהקניית גמישות וחוזק | + | הקרטינים חיוניים לתמיכה מבנית בתא ולהקניית גמישות וחוזק. בנוסף הם מעורבים בבקרה של תהליכים תאיים כגון גדילה, שגשוג ומוות<ref> Schmidt R, Melino G, Candi E, The cornified envelope: a model of cell death in the skin |
| - | <ref> Schmidt R, Melino G, Candi E, The cornified envelope: a model of cell death in the skin | + | |
,Nature Reviews Molecular Cell Biology 2005, 6, 328-340. | ,Nature Reviews Molecular Cell Biology 2005, 6, 328-340. | ||
</ref>. | </ref>. | ||
| - | בנוסף הם מעורבים בבקרה של תהליכים תאיים כגון גדילה, שגשוג ומוות. | ||
<br><br> | <br><br> | ||
| Line 33: | Line 31: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | <scene name='72/728331/Amino_acid/2'>הרצף הראשוני</scene> של הקרטינים משתנה מחלבון לחלבון, | + | <scene name='72/728331/Amino_acid/2'>הרצף הראשוני</scene> |
| - | אך המבנה השניוני שלהם שמור וכולל: אזור ראש (קצה N), אזור זנב (קצה C) ואזור מרכזי. האזור המרכזי בקרטינים הוא בעל אורך שמור והוא מכיל ארבעה <scene name='72/728331/Alpha_helix/1'>סלילי אלפא</scene> ( | + | (כל סוג חומצה אמינית מוצג בהדמיה בצבע אחר) |
| - | + | של הקרטינים משתנה מחלבון לחלבון, | |
| + | אך המבנה השניוני שלהם שמור וכולל: אזור ראש (קצה N), אזור זנב (קצה C) ואזור מרכזי. האזור המרכזי בקרטינים הוא בעל אורך שמור והוא מכיל ארבעה <scene name='72/728331/Alpha_helix/1'>סלילי אלפא</scene> | ||
| + | |||
| + | (ההדמיה מציגה מקטע מתוך שני סיבי קרטין צמודים, בכל סיב מוצג, בצבע ירוק, סליל אלפא אחד מתוך ארבעה). | ||
| + | ככל הידוע, אזור האלפא הליקסים בחלבון הוא האזור המרכזי המאפשר לחלבונים להקשר לחלבונים נוספים וליצור סיבים מבניים. <br> בשרטוט ניתן לראות את אזורי הראש והזנב בקצוות ואת אזורי האלפא הליקס בירוק (השרטוט להמחשה בלבד, גודל המתחמים אינו זהה בין הקרטינים השונים). | ||
| + | <br><br> | ||
</P> | </P> | ||
| - | [[Image: | + | [[Image:מבנה_כללי_קרטין_מתוקן.jpg|right|]] |
<br><br><br><br> | <br><br><br><br> | ||
| Line 43: | Line 46: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | קרטינים | + | קרטינים מחולקים (על פי מידת חומציות) לשתי תתי קבוצות: 28 קרטינים מסוג I ו26 קרטינים מסוג II. |
חלבון קרטין (היחידה המונומרית) מסוג I נקשר במקביל לחלבון קרטין מסוג II, כך שמתקבל מבנה של סליל כפול. הסליל הכפול נקשר בקישור הופכי (antiparallel) לסליל כפול נוסף ונוצר מבנה של טטרמר.<br> | חלבון קרטין (היחידה המונומרית) מסוג I נקשר במקביל לחלבון קרטין מסוג II, כך שמתקבל מבנה של סליל כפול. הסליל הכפול נקשר בקישור הופכי (antiparallel) לסליל כפול נוסף ונוצר מבנה של טטרמר.<br> | ||
[http://www.pha.jhu.edu/~ghzheng/old/webct/note2_5.files/16_016.jpg מבנה הטטרמר] מהווה את יחידת הבסיס ליצירת הסיב. | [http://www.pha.jhu.edu/~ghzheng/old/webct/note2_5.files/16_016.jpg מבנה הטטרמר] מהווה את יחידת הבסיס ליצירת הסיב. | ||
<br><br> | <br><br> | ||
| + | </P> | ||
| + | [[Image:K1K10.jpg|300px|left|thumb|K1/K10 מודל חישובי להטרודימר]] | ||
| + | <p dir='rtl'> | ||
הבנת מבנה הסיבים דורשת גיבוש של הסיב. עם זאת, עד היום לא הצליחו לגבש את הסיבים בשלמותם בגלל האופי בו תת היחידות מחוברות ביניהן, בגלל מחסור באמצעים לקשור את תת היחידות במהלך הגיבוש, ובגלל השוני המבני הגדול בין סיבים שונים. לכן, גובשו מקטעים מתוך הסיבים ולא הסיבים בשלמותם. | הבנת מבנה הסיבים דורשת גיבוש של הסיב. עם זאת, עד היום לא הצליחו לגבש את הסיבים בשלמותם בגלל האופי בו תת היחידות מחוברות ביניהן, בגלל מחסור באמצעים לקשור את תת היחידות במהלך הגיבוש, ובגלל השוני המבני הגדול בין סיבים שונים. לכן, גובשו מקטעים מתוך הסיבים ולא הסיבים בשלמותם. | ||
| - | <br | + | <br> |
| - | + | ||
| - | + | במודל התלת מימדי בערך זה מוצג מקטע מתוך ההטרודימר של קרטין 14 וקרטין 5 (K14/K5). | |
| - | + | המקטע כולל את חומצות האמינו בעמדות 382-476 בקרטין 5, וחומצות האמינו בעמדות 332-421 בקרטין 14. | |
| - | המקטע כולל את חומצות האמינו בעמדות 382-476 בקרטין 5, וחומצות האמינו בעמדות 332-421 בקרטין 14 | + | <br> |
| - | <br | + | להמחשת המקטע המתואר במודל התלת מימדי, מצורף איור של מבנה, המנובא בשיטות חישוביות, של הטרודימר קרטין 1-קרטין 10. |
| - | + | על האיור מסומן בעיגול ובחץ האזור המקביל להטרודימר K14/K5 המתואר בערך זה.<ref> האיור מעובד מתוך: | |
| - | + | Bray DJ, Walsh TR, Noro MG, Notman R, Complete Structure of an Epithelial Keratin Dimer: Implications for Intermediate Filament Assembly,Fig1.d, PLoS One, 2015; 10(7).doi:10.1371/journal.pone.0132706 PMCID: PMC4504709.http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0132706 | |
| - | + | </ref></P> | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | Bray DJ, Walsh TR, Noro MG, Notman R, Complete Structure of an Epithelial Keratin Dimer: Implications for Intermediate Filament Assembly, PLoS One, 2015; 10(7). | + | |
| - | </ref> | + | |
| - | </P> | + | |
<br><br> | <br><br> | ||
| - | |||
==<div style="text-align:right;direction:rtl;">הקשרים הכימיים המחזיקים את סיבי הקרטין</div>== | ==<div style="text-align:right;direction:rtl;">הקשרים הכימיים המחזיקים את סיבי הקרטין</div>== | ||
| - | <Structure load='3TNU' size=' | + | <Structure load='3TNU' size='300' frame='true' align='left' caption=' מקטע סלילי אלפא מקרטין 14 ומקרטין 5' scene='72/728331/Opening/3' /> |
<p dir='rtl'> | <p dir='rtl'> | ||
| - | סיבי הקרטין מוחזקים באמצעות מספר קשרים כימיים: | + | סיבי הקרטין מוחזקים באמצעות מספר קשרים כימיים: קשרים דיסולפידים היכולים להיווצר בין שיירי |
| - | <scene name='72/728331/S_groups/2'> | + | <scene name='72/728331/S_groups/2'>ציסטאין</scene> (מסומנים בהדמיה באדום), |
| - | <scene name='72/728331/Hidrofobic_residdu_new/1'>קשרים הידרופוביים</scene>, קשרי מימן | + | <scene name='72/728331/Hidrofobic_residdu_new/1'>קשרים הידרופוביים</scene>,קשרי מימן וקשרים יונים, היכולים להיווצר בין <scene name='72/728331/Negetive_positive_residues/3'>שיירים טעונים</scene> |
| + | (מסומנים באדום ובורוד).<ref>Fig1.cלמפת הקשרים ליחצו על הקישור ל <br> | ||
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3864793/figure/F1/<br> | http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3864793/figure/F1/<br> | ||
מתוך:Lee CH, Kim MS, Chung BM, Leahy DJ, Coulombe PA, Structural basis for heteromeric assembly and perinuclear organization of keratin filaments,Nat Struct Mol Biol, 2012 Jun 17; 19(7), | מתוך:Lee CH, Kim MS, Chung BM, Leahy DJ, Coulombe PA, Structural basis for heteromeric assembly and perinuclear organization of keratin filaments,Nat Struct Mol Biol, 2012 Jun 17; 19(7), | ||
| - | </ref> | + | </ref> |
<br><br> | <br><br> | ||
קשר דיסולפידי ייחודי נמצא בחומצה אמינית | קשר דיסולפידי ייחודי נמצא בחומצה אמינית | ||
| Line 83: | Line 82: | ||
השייר של | השייר של | ||
החומצה האמינית ציסטאין בעמדה 367 פונה כלפי חוץ ויוצר קשר דיסולפידי עם ציסטאין בעמדה 367 נוסף בהטרודימר שני. המבנה שנוצר בין ההטרודימרים הוא | החומצה האמינית ציסטאין בעמדה 367 פונה כלפי חוץ ויוצר קשר דיסולפידי עם ציסטאין בעמדה 367 נוסף בהטרודימר שני. המבנה שנוצר בין ההטרודימרים הוא | ||
| - | <scene name='72/728331/Tetramer_cys367/ | + | |
| + | <scene name='72/728331/Tetramer_cys367/4'>מבנה בצורת X</scene>. | ||
<br> | <br> | ||
ככל הנראה, מבנה מיוחד זה מעורב בקביעת הצורה והגודל של הגרעין בקרטינוציטים הנמצאים בתחילת ההתמיינות שלהם<ref> | ככל הנראה, מבנה מיוחד זה מעורב בקביעת הצורה והגודל של הגרעין בקרטינוציטים הנמצאים בתחילת ההתמיינות שלהם<ref> | ||
| Line 96: | Line 96: | ||
התסמונת הגנטית הראשונה שזוהתה, הקשורה לסיבי ביניים, היא תסמונת epidermolysis bullosa simplex. בתסמונת זו מתרחשת מוטציה בהטרודימר K14/K5 הגורמת לפגיעה מכנית בתאים הקרטינוציטים באפידרמיס. כתוצאה מכך, מופיעות על עורו של החולה | התסמונת הגנטית הראשונה שזוהתה, הקשורה לסיבי ביניים, היא תסמונת epidermolysis bullosa simplex. בתסמונת זו מתרחשת מוטציה בהטרודימר K14/K5 הגורמת לפגיעה מכנית בתאים הקרטינוציטים באפידרמיס. כתוצאה מכך, מופיעות על עורו של החולה | ||
[http://wiki.ggc.edu/images/9/97/Img0042.jpg שלפוחיות] | [http://wiki.ggc.edu/images/9/97/Img0042.jpg שלפוחיות] | ||
| - | המהוות פגיעה אסטתית חמורה וגורמות לכאבים חזקים | + | המהוות פגיעה אסטתית חמורה וגורמות לכאבים חזקים.<br> |
| - | + | ||
| - | + | ||
| - | + | ||
מיפוי המבנה הקריסטלוגרפי של ההטרודימר K14/K5, הראה שמוטציות רבות, הגורמות למחלות, משפיעות על חומצות אמינו ששרשרות הצד שלהן מעורבות ביצירת מבנה הסליל הכפול. | מיפוי המבנה הקריסטלוגרפי של ההטרודימר K14/K5, הראה שמוטציות רבות, הגורמות למחלות, משפיעות על חומצות אמינו ששרשרות הצד שלהן מעורבות ביצירת מבנה הסליל הכפול. | ||
אזור הידוע כחשוב ביצירת המבנה הסיבי של החלבון הוא | אזור הידוע כחשוב ביצירת המבנה הסיבי של החלבון הוא | ||
| - | <scene name='72/728331/C_prime/1'>רצף חומצות אמינו בקצה C'</scene> של המקטע שגובש. | + | <scene name='72/728331/C_prime/1'>רצף חומצות אמינו בקצה C'</scene> |
| + | (מסומן בהדמיה באדום) | ||
| + | של המקטע שגובש. | ||
רצף זה שמור מאוד בין כל חלבוני סיבי הביניים והוא המאפשר יצירת קשרים לא-הידרופוביים בין הקרטינים. | רצף זה שמור מאוד בין כל חלבוני סיבי הביניים והוא המאפשר יצירת קשרים לא-הידרופוביים בין הקרטינים. | ||
| - | מוטציות באזור זה פוגעות ביצירת המבנה הסיבי וגורמות למחלות שונות. | + | מוטציות באזור זה פוגעות ביצירת המבנה הסיבי וגורמות למחלות שונות |
| + | <ref> | ||
| + | Chamcheu JC, Siddiqui IA, Syed DN, Adhami VM, Liovic M, Mukhtar H, Keratin Gene Mutations in Disorders of Human Skin and its Appendages, Arch Biochem Biophys. 2011 Apr 15; 508(2): 123–137, doi:10.1016/j.abb.2010.12.019, PMCID: PMC3142884 | ||
| + | </ref> | ||
| + | <ref> | ||
| + | Chan YM, Yu QC, LeBlanc-Straceski J, Christiano A, Pulkkinen L, Kucherlapati RS, Uitto J, Fuchs E, Mutations in the non-helical linker segment L1-2 of keratin 5 in patients with Weber-Cockayne epidermolysis bullosa simplex,J Cell Sci. 1994 Apr;107 ( Pt 4):765-74.</ref>. | ||
<br> | <br> | ||
| - | מוטציה נקודתית, למשל, | + | מוטציה נקודתית, למשל, בחומצה אמינית |
| - | גורמת לפגיעה בקשר יוני הנוצר על ידי החומצה, ולמחלה שסופה במוות. | + | <scene name='72/728331/R416/1'> ארגנין בעמדה 416</scene> |
| + | בקרטין 14(מסומנת באדום) | ||
| + | גורמת לפגיעה בקשר יוני הנוצר על ידי החומצה, ולמחלה שסופה במוות | ||
| + | <ref> | ||
| + | Coulombe PA, Hutton ME, Letai A, Hebert A, Paller AS, Fuchs E, Point mutations in human keratin 14 genes of epidermolysis bullosa simplex patients: genetic and functional analyses, Cell, 1991 Sep 20; 66(6):1301-11. | ||
| + | </ref>. | ||
<br> | <br> | ||
הבנה מעמיקה של מבנה הקרטינים ואופן ההתארגנות שלהם כסיבים, תאפשר לסייע לחולים רבים הסובלים כיום ממחלות חשוכות מרפא<ref>Coulombe PA, Kerns ML, Fuchs EJ, Epidermolysis bullosa simplex: a paradigm for disorders of tissue fragility, Clin Invest, 2009 Jul;119(7):1784-93. | הבנה מעמיקה של מבנה הקרטינים ואופן ההתארגנות שלהם כסיבים, תאפשר לסייע לחולים רבים הסובלים כיום ממחלות חשוכות מרפא<ref>Coulombe PA, Kerns ML, Fuchs EJ, Epidermolysis bullosa simplex: a paradigm for disorders of tissue fragility, Clin Invest, 2009 Jul;119(7):1784-93. | ||
Current revision
Contents |
קרטינים
אינמונופלורוסנציה
לקוח מתוך:
https://www.cellapplications.com/human-epidermal-keratinocytes-hek
קרטינים הם קבוצה של חלבונים מבניים המאורגנים במבנה של סיבים, הנקראים סיבי ביניים (intermediate filaments). מוכרים עשרות חלבוני קרטין, הממוספרים במספרים שונים.
הקרטינים מתחלקים לשתי קבוצות: קרטין α - מרכיב את העור, השיער, הצמר, הקרניים, הציפורניים והפרסות של יונקים, וקרטין β - הקשה יותר מקרטין α ומרכיב את הקשקשים והציפורניים של זוחלים, שריוני צבים, וכן את הנוצות והמקור אצל עופות.
הקרטינים חיוניים לתמיכה מבנית בתא ולהקניית גמישות וחוזק. בנוסף הם מעורבים בבקרה של תהליכים תאיים כגון גדילה, שגשוג ומוות[1].
הקרטינים מיוצרים בתאים קרטינוציטים.
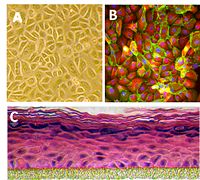
בתמונה משמאל נראית צביעה פלורוסנטית של תאי עור באדם.
בתמונה (A) נראית שכבה של קרטינוציטים, בתמונה (B) קרטין 18 מסומן באדום ואילו בתמונה (C) נראה מודל של התארגנות שכבות הקרטינוציטים
באפידרמיס
(עילית העור). לצפייה בסרטון המתאר את התארגנות הקרטינוציטים באפידרמיס, הכנסו לקישור הבא.
סיבי הקרטין מעוררים ענין רב בעולם המחקר, התעשייה והרפואה בגלל המגוון הגדול שלהם, המחלות הנגרמות בעקבות פגיעה בהם והיישומיים בתחום טיפוח ועיצוב השיער.
מבנה החלבון
(כל סוג חומצה אמינית מוצג בהדמיה בצבע אחר)
של הקרטינים משתנה מחלבון לחלבון,
אך המבנה השניוני שלהם שמור וכולל: אזור ראש (קצה N), אזור זנב (קצה C) ואזור מרכזי. האזור המרכזי בקרטינים הוא בעל אורך שמור והוא מכיל ארבעה
(ההדמיה מציגה מקטע מתוך שני סיבי קרטין צמודים, בכל סיב מוצג, בצבע ירוק, סליל אלפא אחד מתוך ארבעה).
ככל הידוע, אזור האלפא הליקסים בחלבון הוא האזור המרכזי המאפשר לחלבונים להקשר לחלבונים נוספים וליצור סיבים מבניים.
בשרטוט ניתן לראות את אזורי הראש והזנב בקצוות ואת אזורי האלפא הליקס בירוק (השרטוט להמחשה בלבד, גודל המתחמים אינו זהה בין הקרטינים השונים).
התארגנות החלבונים במבנה סיב
קרטינים מחולקים (על פי מידת חומציות) לשתי תתי קבוצות: 28 קרטינים מסוג I ו26 קרטינים מסוג II.
חלבון קרטין (היחידה המונומרית) מסוג I נקשר במקביל לחלבון קרטין מסוג II, כך שמתקבל מבנה של סליל כפול. הסליל הכפול נקשר בקישור הופכי (antiparallel) לסליל כפול נוסף ונוצר מבנה של טטרמר.
מבנה הטטרמר מהווה את יחידת הבסיס ליצירת הסיב.
הבנת מבנה הסיבים דורשת גיבוש של הסיב. עם זאת, עד היום לא הצליחו לגבש את הסיבים בשלמותם בגלל האופי בו תת היחידות מחוברות ביניהן, בגלל מחסור באמצעים לקשור את תת היחידות במהלך הגיבוש, ובגלל השוני המבני הגדול בין סיבים שונים. לכן, גובשו מקטעים מתוך הסיבים ולא הסיבים בשלמותם.
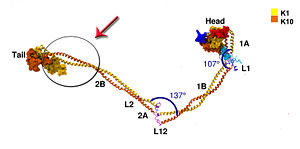
במודל התלת מימדי בערך זה מוצג מקטע מתוך ההטרודימר של קרטין 14 וקרטין 5 (K14/K5).
המקטע כולל את חומצות האמינו בעמדות 382-476 בקרטין 5, וחומצות האמינו בעמדות 332-421 בקרטין 14.
להמחשת המקטע המתואר במודל התלת מימדי, מצורף איור של מבנה, המנובא בשיטות חישוביות, של הטרודימר קרטין 1-קרטין 10.
על האיור מסומן בעיגול ובחץ האזור המקביל להטרודימר K14/K5 המתואר בערך זה.[2]
הקשרים הכימיים המחזיקים את סיבי הקרטין
|
סיבי הקרטין מוחזקים באמצעות מספר קשרים כימיים: קשרים דיסולפידים היכולים להיווצר בין שיירי
(מסומנים בהדמיה באדום),
,קשרי מימן וקשרים יונים, היכולים להיווצר בין
(מסומנים באדום ובורוד).[3]
קשר דיסולפידי ייחודי נמצא בחומצה אמינית
(מסומנת באדום).
הציסטאין בעמדה זו, שמור בין אורתולוגים שונים.
השייר של
החומצה האמינית ציסטאין בעמדה 367 פונה כלפי חוץ ויוצר קשר דיסולפידי עם ציסטאין בעמדה 367 נוסף בהטרודימר שני. המבנה שנוצר בין ההטרודימרים הוא
.
ככל הנראה, מבנה מיוחד זה מעורב בקביעת הצורה והגודל של הגרעין בקרטינוציטים הנמצאים בתחילת ההתמיינות שלהם[4].
היבטים יישומיים ברפואה ובתעשייה
התסמונת הגנטית הראשונה שזוהתה, הקשורה לסיבי ביניים, היא תסמונת epidermolysis bullosa simplex. בתסמונת זו מתרחשת מוטציה בהטרודימר K14/K5 הגורמת לפגיעה מכנית בתאים הקרטינוציטים באפידרמיס. כתוצאה מכך, מופיעות על עורו של החולה
שלפוחיות
המהוות פגיעה אסטתית חמורה וגורמות לכאבים חזקים.
מיפוי המבנה הקריסטלוגרפי של ההטרודימר K14/K5, הראה שמוטציות רבות, הגורמות למחלות, משפיעות על חומצות אמינו ששרשרות הצד שלהן מעורבות ביצירת מבנה הסליל הכפול.
אזור הידוע כחשוב ביצירת המבנה הסיבי של החלבון הוא
(מסומן בהדמיה באדום)
של המקטע שגובש.
רצף זה שמור מאוד בין כל חלבוני סיבי הביניים והוא המאפשר יצירת קשרים לא-הידרופוביים בין הקרטינים.
מוטציות באזור זה פוגעות ביצירת המבנה הסיבי וגורמות למחלות שונות
[5]
[6].
מוטציה נקודתית, למשל, בחומצה אמינית
בקרטין 14(מסומנת באדום)
גורמת לפגיעה בקשר יוני הנוצר על ידי החומצה, ולמחלה שסופה במוות
[7].
הבנה מעמיקה של מבנה הקרטינים ואופן ההתארגנות שלהם כסיבים, תאפשר לסייע לחולים רבים הסובלים כיום ממחלות חשוכות מרפא[8].
היבט נוסף בו תורמת הבנת מבנה הקרטינים הוא בייצור מוצרי טיפוח ועיצוב שיער. בתהליכים של החלקת ועיצוב שיער משתמשים בחומרים כימיים המשנים את הקשרים השונים הבונים את השערה, ביניהם: קשרים דיסולפידים וקשרים יונים. פירוק הקשרים וחיבורם מחדש מאפשר לשנות את מבנה השיער. לקריאה נוספת בנושא זה הכנסו לקישור
הבא.
מקורות מידע
- ↑ Schmidt R, Melino G, Candi E, The cornified envelope: a model of cell death in the skin ,Nature Reviews Molecular Cell Biology 2005, 6, 328-340.
- ↑ האיור מעובד מתוך: Bray DJ, Walsh TR, Noro MG, Notman R, Complete Structure of an Epithelial Keratin Dimer: Implications for Intermediate Filament Assembly,Fig1.d, PLoS One, 2015; 10(7).doi:10.1371/journal.pone.0132706 PMCID: PMC4504709.http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0132706
- ↑ Fig1.cלמפת הקשרים ליחצו על הקישור ל
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3864793/figure/F1/
מתוך:Lee CH, Kim MS, Chung BM, Leahy DJ, Coulombe PA, Structural basis for heteromeric assembly and perinuclear organization of keratin filaments,Nat Struct Mol Biol, 2012 Jun 17; 19(7), - ↑ Lee CH, Kim MS, Chung BM, Leahy DJ, Coulombe PA, Structural basis for heteromeric assembly and perinuclear organization of keratin filaments,Nat Struct Mol Biol, 2012 Jun 17; 19(7)
- ↑ Chamcheu JC, Siddiqui IA, Syed DN, Adhami VM, Liovic M, Mukhtar H, Keratin Gene Mutations in Disorders of Human Skin and its Appendages, Arch Biochem Biophys. 2011 Apr 15; 508(2): 123–137, doi:10.1016/j.abb.2010.12.019, PMCID: PMC3142884
- ↑ Chan YM, Yu QC, LeBlanc-Straceski J, Christiano A, Pulkkinen L, Kucherlapati RS, Uitto J, Fuchs E, Mutations in the non-helical linker segment L1-2 of keratin 5 in patients with Weber-Cockayne epidermolysis bullosa simplex,J Cell Sci. 1994 Apr;107 ( Pt 4):765-74.
- ↑ Coulombe PA, Hutton ME, Letai A, Hebert A, Paller AS, Fuchs E, Point mutations in human keratin 14 genes of epidermolysis bullosa simplex patients: genetic and functional analyses, Cell, 1991 Sep 20; 66(6):1301-11.
- ↑ Coulombe PA, Kerns ML, Fuchs EJ, Epidermolysis bullosa simplex: a paradigm for disorders of tissue fragility, Clin Invest, 2009 Jul;119(7):1784-93.