Keratin (hebrew)
From Proteopedia
| Line 75: | Line 75: | ||
סיבי הקרטין מוחזקים באמצעות מספר קשרים כימיים: | סיבי הקרטין מוחזקים באמצעות מספר קשרים כימיים: | ||
| - | <scene name='72/728331/S_groups/2'>קשרים דיסולפידים</scene>, <scene name='72/728331/ | + | <scene name='72/728331/S_groups/2'>קשרים דיסולפידים</scene>, <scene name='72/728331/Hidrofobic_residdu_new/1'>קשרים הידרופוביים</scene>, קשרי מימן ו<scene name='72/728331/Negetive_positive_residues/3'>קשרי מלח</scene>. במקטע המתואר בערך זה (K5/K14) בקצה C של המולקולה ישנן אינטראקציות פנימיות וחיצוניות של קשרי מלח. אזור זה שמור אבולוציונית ומשערים שהוא אחראי על הנעת תהליך יצירת סיב קרטין מהיחידות הבודדות. מיפוי המטען של המולקולה הראה שהקצה C של המולקולה טעון שלילית ואילו קצה N טעון חיוביות. פער מטעני זה לא נמצא בחלבונים מבניים אחרים, וככל הנראה נדרש לשם חיבור תת היחידות לאוליגומרים. |
<br> | <br> | ||
קשר דיסולפידי ייחודי נמצא בחומצה אמינית | קשר דיסולפידי ייחודי נמצא בחומצה אמינית | ||
Revision as of 10:09, 26 June 2016
Contents |
קרטינים
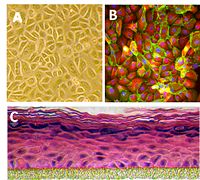
אינמונופלורוסנציה
לקוח מתוך:
https://www.cellapplications.com/human-epidermal-keratinocytes-hek
קרטינים הם קבוצה של חלבונים מבניים המאורגנים במבנה של סיבים, הנקראים סיבי ביניים (intermediate filaments).
הקרטינים מתחלקים לשתי קבוצות: קרטין α - מרכיב את העור, השיער, הצמר, הקרניים, הציפורניים והפרסות של יונקים, וקרטין β - קשה יותר מקרטין α ומרכיב את הקשקשים והציפורניים של זוחלים, שריוני צבים, וכן את הנוצות והמקור אצל עופות.
הקרטינים חיוניים לתמיכה מבנית בתא ולהקניית גמישות וחוזק
[1].
בנוסף הם מעורבים בבקרה של תהליכים תאיים כגון גדילה, שגשוג ומוות.
הקרטינים מיוצרים בתאים קרטינוציטים.
בתמונה משמאל נראית צביעה פלורוסנטית של תאי עור באדם.
בתמונה (A) נראית שכבה של קרטינוציטים, בתמונה (B) קרטין 18 מסומן באדום ואילו בתמונה (C) נראה מודל של התארגנות שכבות הקרטינוציטים
באפידרמיס
(עילית העור). לצפייה בסרטון המתאר את התארגנות הקרטינוציטים באפידרמיס, הכנסו לקישור הבא.
סיבי הקרטין מעוררים ענין רב בעולם המחקר, התעשייה והרפואה בגלל המגוון הגדול שלהם, המחלות הנגרמות בעקבות פגיעה בהם והיישומיים בתחום טיפוח ועיצוב השיער.
מבנה החלבון
של הקרטינים משתנה מחלבון לחלבון,
אך המבנה השניוני שלהם שמור וכולל: אזור ראש (קצה N), אזור זנב (קצה C) ואזור מרכזי. האזור המרכזי בקרטינים הוא בעל אורך שמור והוא מכיל ארבעה (הסלילים מסומנים בהדמיה התלת מימדית בצבע ירוק). ככל הידוע, אזור האלפא הליקסים בחלבון הוא האזור המרכזי המאפשר לחלבונים להקשר לחלבונים נוספים וליצור סיבים מבניים.
בשרטוט ניתן לראות את אזורי הראש והזנב בקצוות ואת אזורי האלפא הליקס בירוק (השרטוט להמחשה בלבד, גודל המתחמים אינו זהה בין הקרטינים השונים).
התארגנות החלבונים במבנה סיב
קרטינים מסוג α מחולקים לשתי תתי קבוצות: 28 קרטינים מסוג I ו26 קרטינים מסוג II. חלבון קרטין (היחידה המונומרית) מסוג I נקשר במקביל לחלבון קרטין מסוג II, כך שמתקבל מבנה של סליל כפול. הסליל הכפול נקשר בקישור הופכי (antiparallel) לסליל כפול נוסף ונוצר מבנה של טטרמר. מבנה הטטרמר מהווה את יחידת הבסיס ליצירת הסיב.
הבנת מבנה הסיבים דורשת גיבוש של הסיב. עם זאת, עד היום לא הצליחו לגבש את הסיבים בשלמותם בגלל האופי בו תת היחידות מחוברות ביניהן, בגלל מחסור באמצעים לקשור את תת היחידות במהלך הגיבוש, ובגלל השוני המבני הגדול בין סיבים שונים. לכן, הוחלט לגבש מקטעים מתוך הסיבים ולא את הסיבים בשלמותם.
המודל התלת מימדי בערך זה מציג מקטע מתוך ההטרודימר של קרטין 14 וקרטין 5. המקטע כולל את חומצות האמינו במיקום 382-476 בקרטין 5, וחומצות האמינו במיקום 332-421 בקרטין 14. בתרשים הבא מסומן בחץ אדום האזור המופיע במודל התלת מימדי.
Image:אזור המודל.jpg
לצפייה במודל של הטרודימר מלא, קרטין 10 וקרטין 1 (K1/K10) הכנסו לקישור: מודל סליל כפול [2]
הקשרים הכימיים המחזיקים את סיבי הקרטין
|
סיבי הקרטין מוחזקים באמצעות מספר קשרים כימיים:
, , קשרי מימן ו. במקטע המתואר בערך זה (K5/K14) בקצה C של המולקולה ישנן אינטראקציות פנימיות וחיצוניות של קשרי מלח. אזור זה שמור אבולוציונית ומשערים שהוא אחראי על הנעת תהליך יצירת סיב קרטין מהיחידות הבודדות. מיפוי המטען של המולקולה הראה שהקצה C של המולקולה טעון שלילית ואילו קצה N טעון חיוביות. פער מטעני זה לא נמצא בחלבונים מבניים אחרים, וככל הנראה נדרש לשם חיבור תת היחידות לאוליגומרים.
קשר דיסולפידי ייחודי נמצא בחומצה אמינית
. במקטע החלבוני המתואר בערך זה ישנן שלוש חומצות אמינו ציסטאין היכולות לתרום את הקבוצה הצידית שלהם לקשרים דיסולפידים. בקרטין 5 ישנו ציסטאין 407 ששרשרת הצד שלו ממוקמת בשטח הפנימי של החלבון. בקרטין 14 ישנם שני ציסטאינים 367 ו389. החומצה האמינית ציסטאין בעמדה 367 פונה כלפי חוץ ויוצרת קשר דיסולפידי עם ציסטאין 367 נוסף בהטרודימר שני. הציסטאין בעמדה זו, שמור בין אורתולוגים שונים. המבנה שנוצר בין ההטרו דימרים הוא מבנה של X. ככל הנראה, מבנה מיוחד זה מעורב בקביעת הצורה והגודל של הגרעין בקרטינוציטים הנמצאים בתחילת ההתמיינות שלהם.
<p>
השלכות והיבטים רפואיים
<p dir='rtl'>
מחלות אפידרמליות רבות נגרמות כתוצאה ממוטציות בחלבונים מבניים. הבנת מבנה חלבונים אלו הכרחית לפיתוח טיפולים שונים במחלות. התסמונת הגנטית הראשונה שזוהתה, הקשורה לסיבי ביניים, היא תסמונת epidermolysis bullosa simplex (EBS). בתסמונת זו מוטציה בהטרודימר קרטין 14-קרטין 5 גורמת לפגיעה מכנית בתאים הקרטינוציטים באפידרמיס. כתוצאה מכך, מופיעות על עורו של החולה יבלות (להוסיף קישור לתמונה) המהוות פגיעה אסטתית חמורה וגורמות לכאבים חזקים.
[3]
במקטע החלבון המתואר במודל בערך זה ישנן חומצות אמינו שמוטציות החלפה שונות בהן, ידועות כגורמות למחלות אפידרמליות. במיפוי של אזורי המוטציות נמצא שהן הופיעו בשני אזורים עיקריים: מרכז הסליל הרביעי ובקצה C.
המוטציות הן משני סוגים: מוטציות באזורים הפנימיים של הסליל הכפול ומוטציות באזורים החיצוניים של הסליל הכפול. מיפוי המבנה הקריסטלוגרפי של ההטרודימר הראה שמוטציות רבות, הגורמות למחלה, משפיעות על חומצות אמינו ששרשרות הצד שלהן מעורבות ביצירת מבנה הסליל הכפול.
בקצה C של האזור שגובש ישנו רצף השמור מאוד בין כל חלבוני סיבי הביניים. באזור זה מתקיימות אינטראקציות לא הידרופוביות בין קרטין 14 וקרטין 5. אינטראקציות אלו חשובות ליצירת המבנה הסיבי של החלבונים. מוטציות במוטיב משפיעות על השיירים שלו ופוגעות ביצירת הסלילים הכפולים.
הבנה מעמיקה של מבנה הקרטינים ואופן ההתארגנות שלהם כסיבים, תאפשר לסייע לחולים רבים הסובלים כיום ממחלות חשוכות מרפא.
[4]
מקורות מידע
- ↑ The cornified envelope: a model of cell death in the skin Eleonora Candi, Rainer Schmidt & Gerry Melino Nature Reviews Molecular Cell Biology 6, 328-340 (April 2005) http://www.nature.com/nrm/journal/v6/n4/fig_tab/nrm1619_F2.html.
- ↑ PLoS One. 2015; 10(7): e0132706.Published online 2015 Jul16. doi: 10.1371/journal.pone.0132706 PMCID: PMC4504709 Complete Structure of an Epithelial Keratin Dimer: Implications for Intermediate Filament Assembly David J. Bray,1,2 Tiffany R. Walsh,3,* Massimo G. Noro,4 and Rebecca Notman1,2,*
- ↑ Coulombe PA, Hutton ME, Letai A, Hebert A, Paller AS, Fuchs E, Point mutations in human keratin 14 genes of epidermolysis bullosa simplex patients: genetic and functional analyses. Cell. 1991 Sep 20; 66(6):1301-11.
- ↑ Coulombe PA1, Kerns ML, Fuchs E. J Clin Invest. Epidermolysis bullosa simplex: a paradigm for disorders of tissue fragility. 2009 Jul;119(7):1784-93.
