User:Carlos Vázquez García/TFG/Parte3
From Proteopedia
| Line 4: | Line 4: | ||
<p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">6.2.1. Mecanismo de activación e inactivación de K-RAS</p> | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">6.2.1. Mecanismo de activación e inactivación de K-RAS</p> | ||
| - | <span style="margin-left:10px;float:right;display:inline-block;">[[Image:Cascadareducida.png]]</ | + | <span style="margin-left:10px;float:right;display:inline-block;">[[Image:Cascadareducida.png]]<p style="float:right;width:300px;display:inline-block;">Figura 3. Cascada de señales con ruta por MAP Kinasas que parte del receptor de crecimiento epidérmico.</p> |
| - | + | </span> | |
<p style="font-size:14px;text-align:justify;margin-left:10px;width:98%;">En la introducción de este trabajo se comentó la intensa participación de esta proteína en la regulación de la proliferación celular. De forma intuitiva y asequible se podría decir que K-RAS actúa como un interruptor en la cascada de señalización celular. Para ello se sirve de dos ligandos: GTP (Guanosín 5’-trifosfato) y GDP (Guanosín 5’-difosfato). Cuando el GDP está unido en el "bolsillo" o sitio de unión la proteína se encuentra en una conformación inactiva. El GDP puede ser reemplazado por GTP mediante una ruta de señalización mediada por proteínas SOS, provocando un cambio de conformación hacia la forma activa. Tras este fenómeno la proteína transmite una cascada de señales vía MAP Kinasas que desemboca en el núcleo y promueve la transcripción de genes específicos.</p> | <p style="font-size:14px;text-align:justify;margin-left:10px;width:98%;">En la introducción de este trabajo se comentó la intensa participación de esta proteína en la regulación de la proliferación celular. De forma intuitiva y asequible se podría decir que K-RAS actúa como un interruptor en la cascada de señalización celular. Para ello se sirve de dos ligandos: GTP (Guanosín 5’-trifosfato) y GDP (Guanosín 5’-difosfato). Cuando el GDP está unido en el "bolsillo" o sitio de unión la proteína se encuentra en una conformación inactiva. El GDP puede ser reemplazado por GTP mediante una ruta de señalización mediada por proteínas SOS, provocando un cambio de conformación hacia la forma activa. Tras este fenómeno la proteína transmite una cascada de señales vía MAP Kinasas que desemboca en el núcleo y promueve la transcripción de genes específicos.</p> | ||
| Line 12: | Line 12: | ||
<p style="font-size:14px;text-align:justify;margin-left:10px;width:98%;">Una vez comentado brevemente el mecanismo se estudiarán los ligandos susceptibles de unirse a la proteína.</p> | <p style="font-size:14px;text-align:justify;margin-left:10px;width:98%;">Una vez comentado brevemente el mecanismo se estudiarán los ligandos susceptibles de unirse a la proteína.</p> | ||
| - | |||
| - | <p style="float:right;width:300px;display:inline-block;">Figura 3. Cascada de señales con ruta por MAP Kinasas que parte del receptor de crecimiento epidérmico.</p> | ||
<p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">6.2.2. Bolsillo de la proteína</p> | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">6.2.2. Bolsillo de la proteína</p> | ||
Revision as of 20:05, 25 March 2016
6.2. Función y Mecanismo de K-RAS. Ligandos y sitios de unión.
Este apartado cobra especial relevancia al entender que los ligandos y los sitios de unión son aspectos estrechamente relacionados con la función de una proteína. Un ligando es aquella molécula susceptible de unirse a una proteína. Pero la unión no se realiza en cualquier parte, sino en una región específica que se denomina bolsillo. Es en este lugar donde se dan determinadas circunstancias que permiten el acomodamiento del ligando. Generalmente las interacciones suelen ser electrostáticas e hidrofóbicas, y van acompañadas de una correcta disposición espacial en la proteína que genera cavidades apropiadas para el ligando. Una idea a reseñar sobre este concepto es que dependiendo del ligando la proteína se plegará y actuará de un modo u otro. Antes de comenzar a hablar en detalle sobre los ligandos y el bolsillo, hay que recordar que un enzima puede tener algún otro sitio donde ciertas moléculas puedan unirse para modular la función de la proteína. Este tipo de regulación recibe el nombre de regulación alostérica, y se verá reflejado fundamentalmente en el apartado de los ligandos recientemente descubiertos.
6.2.1. Mecanismo de activación e inactivación de K-RAS
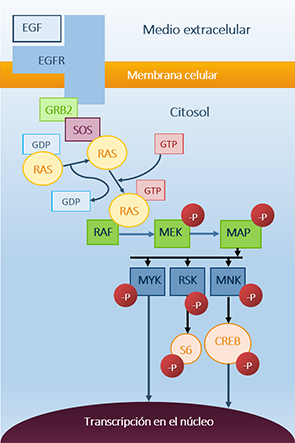
Figura 3. Cascada de señales con ruta por MAP Kinasas que parte del receptor de crecimiento epidérmico.
En la introducción de este trabajo se comentó la intensa participación de esta proteína en la regulación de la proliferación celular. De forma intuitiva y asequible se podría decir que K-RAS actúa como un interruptor en la cascada de señalización celular. Para ello se sirve de dos ligandos: GTP (Guanosín 5’-trifosfato) y GDP (Guanosín 5’-difosfato). Cuando el GDP está unido en el "bolsillo" o sitio de unión la proteína se encuentra en una conformación inactiva. El GDP puede ser reemplazado por GTP mediante una ruta de señalización mediada por proteínas SOS, provocando un cambio de conformación hacia la forma activa. Tras este fenómeno la proteína transmite una cascada de señales vía MAP Kinasas que desemboca en el núcleo y promueve la transcripción de genes específicos.
La desactivación o vuelta a la conformación inicial tiene un mecanismo basado en una reacción de hidrólisis, en la que el sustrato (GTP) situado sobre el centro catalítico o bolsillo del enzima, y con la ayuda del catión Mg2+, es transformado en GDP. El proceso tiene su origen con el ataque del par electrónico del Oxígeno del agua sobre el grupo fosfato terminal, concretamente sobre el Fósforo que actúa como centro nucleófilo. Como consecuencia de este ataque se produce la escisión del grupo fosfato terminal, a través del enlace P-O-P.
Una vez comentado brevemente el mecanismo se estudiarán los ligandos susceptibles de unirse a la proteína.
6.2.2. Bolsillo de la proteína
Como se mencionó líneas arriba el bolsillo es el lugar de unión con los ligandos. En el caso de esta proteína existe un bolsillo relevante al que se denominará principal, pues será el que incorpore en su interior a GTP y GDP [4]. Sin embargo, estudios actuales están encontrando "bolsillos accesorios" en la proteína, y que son descritos gracias a la cristalización de esta proteína con moléculas experimentales [5].
Antes de comenzar a describir la estructura del bolsillo hay que mencionar que el número de residuos que intervienen y sus disposiciones espaciales varían según el ligando que esté unido. Por esta razón se tomará como referencia los aminoácidos intervinientes en la unión con GTP, aprovechando que son más numerosos y pueden dar una idea más aproximada.
| Glicina | 12 |
| Glicina | 13 |
| Valina | 14 |
| Glicina | 15 |
| Lisina | 16 |
| Serina | 17 |
| Alanina | 18 |
| Fenilalanina | 28 |
| Valina | 29 |
| Ácido Aspártico | 30 |
| Glutámico | 31 |
| Tirosina | 32 |
| Prolina | 34 |
| Treonina | 35 |
| Alanina | 59 |
| Glicina | 60 |
| Aparagina | 116 |
| Lisina | 117 |
| Ácido aspártico | 119 |
| Leucina | 120 |
| Serina | 145 |
| Alanina | 146 |
| Lisina | 147 |
Tabla 3. Principales residuos que conforman el bolsillo principal de K-RAS.
La disposición espacial del bolsillo principal puede contemplarse en el modelo tridimensional situado aquí.
|
