Peptidyl-tRNA hydrolase 2, mitochondrial (Hebrew)
From Proteopedia
| Line 1: | Line 1: | ||
| - | <Structure load='1Q7S' size='350' frame='true' caption='[https://www.rcsb.org/structure/1Q7S 1Q7S]' align=' | + | <Structure load='1Q7S' size='350' frame='true' caption='[https://www.rcsb.org/structure/1Q7S 1Q7S]' align='left' scene='Insert optional scene name here' /> |
==<p dir='rtl' style="font-size:30px;">'''רנ״א מוביל הידרולאז 2 מיטוכונדריאלי'''</p>== | ==<p dir='rtl' style="font-size:30px;">'''רנ״א מוביל הידרולאז 2 מיטוכונדריאלי'''</p>== | ||
Revision as of 05:09, 5 March 2024
|
Contents |
רנ״א מוביל הידרולאז 2 מיטוכונדריאלי
תהליך תרגום
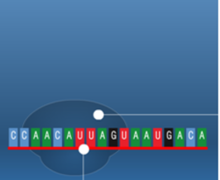
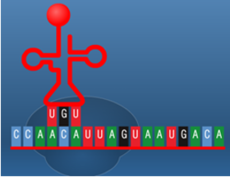
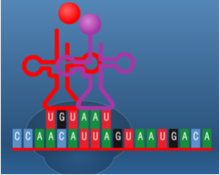
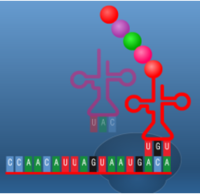
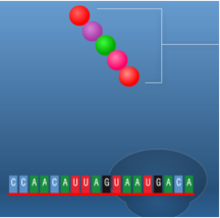
תהליך התרגום הוא תהליך ביולוגי חיוני המתרחש בכל תאי היצורים החיים ומשמש לייצור חלבונים. החלבונים מבצעים את רוב התהליכים בתאים חיים כולל תפקידים קטליטיים ,מעורבים ביצירת מבנה התא , העברת אותות ועוד.תהליך התרגום מתרחש על ידי הריבוזום שהינו קומפלקס גדול העשוי מחלבון ומרנ"א . הריבוזום נקשר למולקולות של רנ"א שליח (m-RNA) המורכבות מנוקלאוטידים ועל בסיסם הוא מייצר חלבונים, כל שלושה נוקלאוטידים (אבני הבניין של הרנ"א ) מרכבים קודון שמקודד לחומצת אמינו מסוימת . יצירת החלבון על סמך רצף הקודונים נעשית על ידי מולקולות רנ"א מוביל (t-RNA) שנקשרות לרנ"א שליח ונושאות את חומצת האמינו המתאימה .כל חומצת אמינו חדשה שמתווספת מייצרת קשר פפטידי עם חומצת האמינו הקודמת. באופן הזה נוצר רצף של חומצות אמינו אשר מהוות את החלבון השלם המתקפל לאחר מכן לצורתו התלת – ממדית הפעיל, הקוד מאפשר לתא ליצור חלבונים בעלי רצף קבוע וחזוי מראש עם מבנה ותפקיד . שלבי תהליך התרגום בתמונות הבאות (מימין לשמאל )מתוארת בניית שרשרת חומצות אמיניות קצרה באורך 5 חומצות אמיניות בלבד.
החשיבות של בקרה בתהליך התרגום
למרות החשיבות הרבה של תהליך התרגום ליצירת חלבונים תקינים ופעילים ,ךעתים תהליך זה עלול להסתיים מוקדם מדי כתוצאה מכך זה יוביל ליצירת חלבונים לקויים לא פעילים. סיום מוקדם גורם להצטברות של חלבונים לקויים בתא וזה יכול להיות רעיל ויכול לפגוע בתפקוד התאי , לכן קיימים מנגנוני בקרה שמטרתם לזהות ולהתמודד עם יצרית חלבונים הלקויים אחד מהמנגנונים החשובים הוא פעילות האנזים PTRH2 אשר משחרר החלבון ממולקולת t-RNA שמאפשר לתא להשמיד את החלבון הלקוי וכך התא מבטיח שרק חלבונים תקינים ופעילים משתתפים בתהליכים חיוניים בתא במקום להיות רעילים לתאים .
המבנה של החלבון
|
החלבון PTRH2
במשקל מולקולרי של 19 קילו-דלטון (KDa) ומורכב מ179 חומצות אמינו , נחשב הומודמיר , שייר a צבע כחול שייר b כחול בהיר וכל שייר בו מורכב משני חלקים עיקרים חלק ראשון הוא רצף סיגנל -רצף חומצות אמינו בתחילת החלבון משמש ככתובת להובלת החלבון למיטוכונדריה ששם הוא ממלא את תפקידו הביולוגי (שהחלק הזה אינו מוצג במבנה ) , והחלק השני אחראי על ההידרוליזה הקטליטית המשמש לפעילות החלבון , הרצף הקטליטי מעורב בתפקיד החיוני של החלבון ובהישרדות התא והוא מעמדה 63 עד 179 (שזה כל החלבון המוצג בתמונה איפה ציינו chain a and b) ,החלבון מתואר בשלושה מבנים מבנה ראשוני שמתאר רצף חומצות האמינו של החלבון , מבנה שניוני שמתייחס לקיפולים המקומיים של החלבון והם כוללים סלילי אלפא (צבועים באפור) ומחישה דפי בטא , המקטע 80-99 צבוע כחול-אפור הינו אלפא הלקס הכי גדול במבנה והוא מעורב בקישור לחלבונים שונים שהקישור הזה יכול להשפיע על מגוון פונקציות תאיות ותהליכים כמו העברת אותות ,ותהליכים מטבוליים וכך שולטים ומווסתים פעילות חלבונים שונים . העמדה 85 המכילה חומצה אמינו גלוטמין היא חלק חשוב מרשת אינטראקציות אלקטרוסטטיות עם חומצת אמינו תראונין בעמדה 157, חומצה אמינו אספרטט בעמדה 145 ,וחומצה אמינו ליזין בעמדה 81 . הרשת אינטראקציות מייצבת את החלבון ועוזרת לשמור על המיקום הנכון של הסליל אלפא בין העמדות ודפי בטא, פעילותו הפונקציונלית ,קיפולו ,ושמרת המבנה התלת ממדי . החומצה האמינו גלוטמין בעמדה 85 , חומצה אמינו ליזין בעמדה 81, וחומצה אמינו תראונין בעמדה 157 הינם חלק מהאתר הפעיל .החומצה אמינו תירוזין בעמדה 94 בצבע ירוק נמצאת באינטראקציות עם עמדות סמוכות כולל קשרי מימן ואינטראקציות הידרופוביות שהם חשובות לקיפול החלבון ולפונקציה של החלבון .
מחלות ומוטציות בחלבון
IMNEPD היא מחלה נדירה הנגרמת על ידי מוטציות בגן PTRH2 משפיעה על מערכות הנוירולוגית ,האנדוקרינית והלבלב .המחלה קיימת באוכלוסיות שונות ברחבי העולם כולל קהילות ערביות. חומרת המחלה נעה בהתאם לסוג המוטציה בגן PTRH2 כאשר מאופיינת בספקטרום רחב של תסמינים כולל פיגור התפתחותי , בעיות שמיעה, אטקסיה (קשיים בשמירה על שיווי משקל)ובעיות בלבלב . מוכר מספר מוטציות בחלבון שמובילות למחלה כאשר כל מוטציה משפיעה באופן שונה על החלבון שבסוף מובילות למחלה כמו
- מוטציית החלפת חומצות אמינו בעמדה 85 במקום הגלוטמין (Q) לפרולין(P):
היא נחשבת מבין המוטציות הנפוצות ביותר בקרב הקהילות הערביות השכיחות שלה 56%, היא מובילה להפחתה ביציבות החלבון ובפעילותו הקטליטית של האנזים , כאשר עמדה 85 מאבדת את אינטראקציות בין חומצות אמינו אחרות עקב החלפתה בחומצה אמינו פרולין שאינה מסוגלת לקיים אותם קשרים כתוצאה מכך מופחתת יציבות ופעילות החלבון כאשר האינטראקציות אבדו ולא ניתן לתמוך במבנה ובתפקוד הנכון של החלבון .המוטציה הזו עלולה להוביל לפנוטיפ עדין יותר של המחלה בהשוואה למוטציות שונות.
- 43Kfs*11:
מוטציה שגורמת להזזת מסגרת הקריאה , נוצרת הזזה במסגרת הקריאה של הקודונים של הדנ"א ובכך מוביל לסיום מוקדם של תהליך התרגום , לאחר 11 חומצות אמינו . כתוצאה מכך נוצר חלבון מקוטע שאינו מלא ולא פונקציונלי.
- המוטציה Y94N:
מתארת החלפת חומצה אמינו מתירוזין (Y) לאספרגין (N)בעמדה 94 , לפי תיאור המבנה של החלבון העמדה נחשבת חלק מהאלפא הליקס הגדול 80-99 שמשומש כאתר קישור לחלבון, כתוצאה מכך תשפיע המוטציה באופן שלילי על האינטראקציות בין החלבון PTRH2 לחלבונים אחרים .
-
המוטציות W108 ו110E:
גורמות ליצירת חלבון PRTH2 מקוטע המוטציה W108 היא מוטציית סיום , והמוטציה 110E היא סינתזת החלבון ללא חלק מהמקטע ההידרוליזה הקטליטית של החלבון , שתי המוטציות משפיעות על יכולתו לבצע את הפונקציה שלו
חשוב לזכור שמוטציות באנשים שונים יכולה להיות שונות בהתבטאות המחלה ,התובנה שביטוי הפנוטיפ משתנה באופן משמעותי בגלל שהוא תלוי בגורמים גנטיים נוספים ,סביבתיים ואינטראקציות בין גנים לסביבה .
שאלות
מקורות
- Sharkia, R., Jain, S., Mahajnah, M., Habib, C., Azem, A., Al-Shareef, W., & Zalan, A. (2023). PTRH2 Gene Variants: Recent Review of the Phenotypic Features and Their Bioinformatics Analysis. Genes, 14(5), 1031. https://www.mdpi.com/2073-4425/14/5/1031
- מכון דוידסון. (2015, ספטמבר 7). איך נוצר תהליך התרגום. מכון דוידסון לחינוך מדעי. נלקח מ https://davidson.weizmann.ac.il/online/askexpert/life_sci/%D7%90%D7%99%D7%9A-%D7%A0%D7%95%D7%A6%D7%A8-%D7%AA%D7%94%D7%9C%D7%99%D7%9A-%D7%94%D7%AA%D7%A8%D7%92%D7%95%D7%9D
- מטח - נחשון. (n.d.). התא – מבנה ותפקוד מ-DNA לחלבון [מצגת PowerPoint]. מתוך https://misgav.iscool.co.il/LinkClick.aspx?fileticket=f58X85a83ZU%3D&tabid=514&mid=14011&language=he-IL