Aricept Complexed with Acetylcholinesterase (Spanish)
From Proteopedia
(Difference between revisions)
m |
|||
| (12 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
| + | <StructureSection load='1eve' size='450' side='right' scene='29/2908/1eve_e20_cartoon/1' caption=''> | ||
[[Image:E2020_interactins_in_AChE_gorge.jpg|left|250px]]<br /> | [[Image:E2020_interactins_in_AChE_gorge.jpg|left|250px]]<br /> | ||
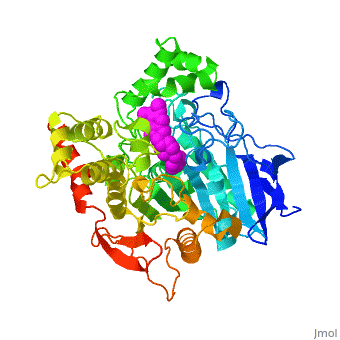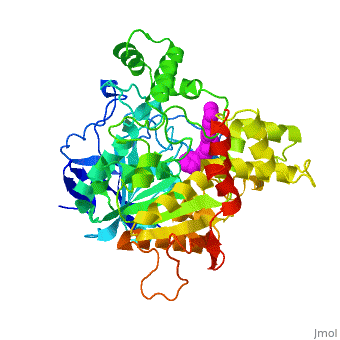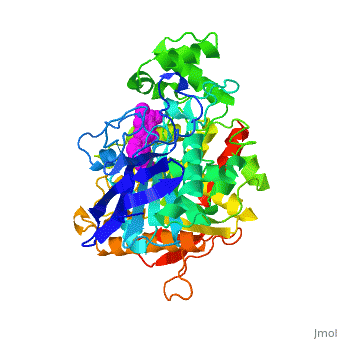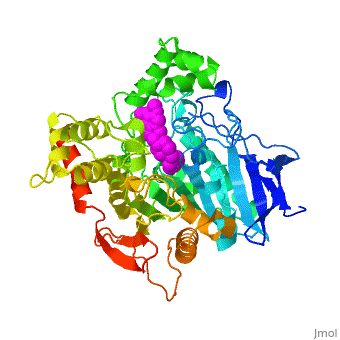
| - | + | '''Estructura tridimensional de Aricept, un fármaco contra la enfermedad de Alzheimer, unido a la acetilcolinesterasa''' | |
| - | + | (véase tambien [[AChE bivalent inhibitors (Part II)]]) | |
| - | + | ||
| - | '''Estructura tridimensional de | + | |
| - | ( | + | |
==Antecedentes== | ==Antecedentes== | ||
| - | Varios inhibidores de la colinesterasa se utilizan para el tratamiento sintomático de la enfermedad de Alzheimer o se encuentran en estado avanzado de ensayo clínico. '''E2020''', comercializado como '''Aricept''', | + | Varios inhibidores de la colinesterasa se utilizan para el tratamiento sintomático de la enfermedad de Alzheimer o se encuentran en estado avanzado de ensayo clínico. '''E2020''', comercializado como '''Aricept''', pertenece a la numerosa familia de la N-benzilpiperidina, basada en inhibidores de la [[acetylcholinesterase|acetilcolinesterasa]] (AChE). '''Aricept''' ha sido desarrollado, sintetizado y evaluado por la compañía Eisai en el Japón. Estos inhibidores se diseñaron a partir de estudios QSAR, antes de conocerse la estructura tridimensional de la AChE de ''Torpedo californica'' (''Tc''AChE) ([[1ea5]]). Con este inhibidor se mejora significativamente el rendimiento en modelos animales de hipofunción colinérgica y tiene una alta afinidad por la AChE, uniéndose a concentraciones nanomolares a la AChE tanto de anguila eléctrica como de ratón. |
{{Clear}} | {{Clear}} | ||
| - | <applet load='1eve.pdb' size='500' frame='true' align='right' scene='Main_Page/E2020_in_ache_spinning/1' /> | ||
| - | |||
==Resultados== | ==Resultados== | ||
| - | La estructura de rayos X | + | La estructura obtenida por difracción de rayos X para el complejo E2020-''Tc''AChE pone de manifiesto que el E2020 tiene una orientación <scene name='1eve/E2020_close_up_with_84_279/13'>única</scene> a lo largo de la hendidura del sitio activo, extendiéndose desde el sub-sitio aniónico (<scene name='1eve/E2020_close_up_with_84lbld/7'>W84</scene>) del sitio activo, abajo, hasta el sitio aniónico periférico (<scene name='1eve/E2020_close_up_with_84_279lbld/5'>cerca de W279</scene>), arriba, gracias a interacciones de apilamiento con residuos aromáticos conservados. Sin embargo, E2020 no interacciona directamente con la tríada catalítica ni con el 'hueco del oxianión', sino sólo <scene name='1eve/E20_interactionshown/8'>indirectamente</scene> a través de moléculas del disolvente. |
==Conclusiones== | ==Conclusiones== | ||
| - | La estructura de | + | La estructura obtenida con difracción de rayos X muestra, a posteriori, que el diseño de E2020 ha aprovechado varias características importantes de la hendidura del sitio activo de la AChE, produciendo una droga con alta afinidad y alta selectividad, comparada con la butirilcolinesterasa (BChE). Asimismo, delimita huecos dentro de la hendidura que no están ocupados por E2020 y podrían proporcionar sitios para una modificación potencial de E2020 de cara a producir drogas con mejores capacidades farmacológicas. |
| - | + | ||
| - | + | ||
| - | + | ||
| + | ==Acerca de esta estructura== | ||
| + | 1EVE es una [http://es.wikipedia.org/wiki/Proteína proteína] de una sola cadena, procedente de [http://en.wikipedia.org/wiki/Torpedo_californica ''Torpedo californica''], con ''N''-acetilglucosamina y E2020 como [http://es.wikipedia.org/wiki/Ligando ligandos] (identificadores NAG y E20 en el modelo). Es activa como [[Acetylcholinesterase | acetilcolinesterasa]], con el número [http://www.brenda-enzymes.info/php/result_flat.php4?ecno=3.1.1.7 EC 3.1.1.7]. Hay información cristalográfica completa en [http://ispc.weizmann.ac.il/oca-bin/ocashort?id=1EVE OCA]. | ||
| + | También se ilustra, de forma más sencilla, en un artículo 'Molécula del mes' de David S. Goodsell en el Protein Data Bank: ''[http://dx.doi.org/10.2210/rcsb_pdb/mom_2004_6 Acetylcholinesterase: Molecule of the Month, June 2004]''. | ||
| + | </StructureSection> | ||
==Referencias== | ==Referencias== | ||
<ref group=xtra>PMID:10368299</ref><references group=xtra/> | <ref group=xtra>PMID:10368299</ref><references group=xtra/> | ||
| - | + | ||
| + | [[ar:Aricept_Complexed_with_Acetylcholinesterase (Arabic)]] | ||
| + | [[ca:Aricept_Complexed_with_Acetylcholinesterase (Catalan)]] | ||
| + | [[zh:Aricept_Complexed_with_Acetylcholinesterase (Chinese)]] | ||
| + | [[cs:Aricept_Complexed_with_Acetylcholinesterase (Czech)]] | ||
| + | [[de:Aricept_Complexed_with_Acetylcholinesterase (German)]] | ||
| + | [[en:Aricept_Complexed_with_Acetylcholinesterase]] | ||
| + | [[es:Aricept_Complexed_with_Acetylcholinesterase (Spanish)]] | ||
| + | [[fr:Aricept_Complexed_with_Acetylcholinesterase (French)]] | ||
| + | [[he:Aricept_Complexed_with_Acetylcholinesterase (Hebrew)]] | ||
| + | [[it:Aricept_Complexed_with_Acetylcholinesterase (Italian)]] | ||
| + | [[ru:Aricept_Complexed_with_Acetylcholinesterase (Russian)]] | ||
| + | [[sk:Aricept_Complexed_with_Acetylcholinesterase (Slovak)]] | ||
| + | [[vi:Aricept_Complexed_with_Acetylcholinesterase (Vietnamese)]] | ||
| + | [[tr:Aricept_Complexed_with_Acetylcholinesterase (Turkish)]] | ||
[[Category: Acetylcholinesterase]] | [[Category: Acetylcholinesterase]] | ||
| Line 40: | Line 51: | ||
[[Category: neurotransmitter cleavage]] | [[Category: neurotransmitter cleavage]] | ||
[[Category: serine hydrolase]] | [[Category: serine hydrolase]] | ||
| + | [[Category: Pages in Spanish]] | ||
Current revision
| |||||||||||
Referencias
- Kryger G, Silman I, Sussman JL. Structure of acetylcholinesterase complexed with E2020 (Aricept): implications for the design of new anti-Alzheimer drugs. Structure. 1999 Mar 15;7(3):297-307. PMID:10368299
Proteopedia Page Contributors and Editors (what is this?)
Jaime Prilusky, Joel L. Sussman, Fred Vellieux, Alexander Berchansky, Angel Herraez