Sandbox Reserved 612
From Proteopedia
| (15 intermediate revisions not shown.) | |||
| Line 12: | Line 12: | ||
.אנזים זה מאפשר להחליף את הקואנזים הקשור לחומצת השומן ,בקרנטין | .אנזים זה מאפשר להחליף את הקואנזים הקשור לחומצת השומן ,בקרנטין | ||
<br /> | <br /> | ||
| - | + | ==מבנה== | |
| - | האנזים בנוי משתי תת יחידות שזהות בקיפולן. האתר הפעיל נמצא בתווך שבין שתי תת היחידות ומכיל שלש חומצות אמינו שכנראה משתתפות במנגנון הקטליזה. | + | |
| - | היסטידין בעמדה 473 , חומצה אספרטית בעמדה 454 וציסטאין בעמדה 304 | + | האנזים בנוי משתי תת יחידות שזהות בקיפולן. האתר הפעיל נמצא בתווך שבין שתי תת היחידות ומכיל שלש חומצות אמינו שכנראה משתתפות במנגנון הקטליזה.היסטידין בעמדה 473 , חומצה אספרטית בעמדה 454 וציסטאין בעמדה 304 |
| - | + | </p> | |
<br /> | <br /> | ||
==מנגנון קטליזה== | ==מנגנון קטליזה== | ||
| + | <p dir='rtl'> | ||
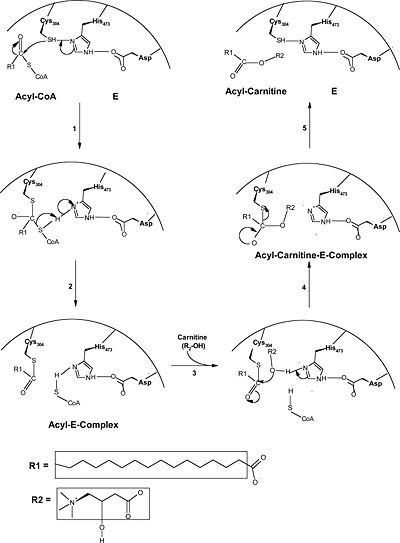
האנזים פוגש את חומצת השומן שמחוברת לקואנזים . בתחילה (בשלב 1+2 בשרטוט) ,בעזרת שני השיירים, ציסטאין בעמדה 304 ,והיסטידין בעמדה 473, הקואנזים -חומצת השומן, מתפרק כך שחומצת השומן ניקשרת לציסטיאן והקואנזים ניקשר להיסטידין. | האנזים פוגש את חומצת השומן שמחוברת לקואנזים . בתחילה (בשלב 1+2 בשרטוט) ,בעזרת שני השיירים, ציסטאין בעמדה 304 ,והיסטידין בעמדה 473, הקואנזים -חומצת השומן, מתפרק כך שחומצת השומן ניקשרת לציסטיאן והקואנזים ניקשר להיסטידין. | ||
| - | <br /> | ||
הקישור להיסטידין מתאפשר בעזרת האינטראקציה בן השייר של החומצה האספרטית בעמדה 454 וההיסטדין. | הקישור להיסטידין מתאפשר בעזרת האינטראקציה בן השייר של החומצה האספרטית בעמדה 454 וההיסטדין. | ||
| - | + | בהמשך (שלבים 3+4 בשרטוט) הקואנזים משתחרר והקרנטין מתחבר לפחמן הקרבונילי של חומצת השומן שמחוברת עדיין לאנזים דרך ציסטאין בעמדה 304 | |
| - | + | ||
| - | + | ||
בשלב האחרון חומצת השומן-קרנטין משתחררים מהאנזים . השייר של חומצת האמינו ציסטאין יוצר אינטראקציה חדשה עם היסטדין 473 | בשלב האחרון חומצת השומן-קרנטין משתחררים מהאנזים . השייר של חומצת האמינו ציסטאין יוצר אינטראקציה חדשה עם היסטדין 473 | ||
| - | [[Image:F3.large.jpg|left|400px|thumb|Mechanism]] | ||
| - | <scene name='User:Amir_Mitchell/hebrew_amylase/Ligand_zoom/1'>סובסטרטים</scene> | ||
| - | [http://stwww.weizmann.ac.il/g-junior/nutrition/ART/strach.gif ---עמילן] | ||
| - | [http://chemistry.gcsu.edu/~metzker/Common/Structures/Carbohydrates/Glycogen.png ---וגליקוגן]. | ||
| - | [http://upload.wikimedia.org/wikipedia/commons/e/e9/Glucose-2D-skeletal.png ---לגלוקוז] או | ||
| - | [http://upload.wikimedia.org/wikipedia/commons/0/0c/Maltose2.png ---מלטוז]. | ||
| - | כל יחידת מלטוז מכילה שתי יחידות של חד סוכר ששמו גלוקוז המחוברות ביניהן בקשר כימי. | ||
| - | כאשר לועסים במשך זמן מה מזונות המכילים הרבה עמילן כמו אורז או תפוחי אדמה, מרגישים בפה טעם מתקתק בגלל פעילות העמילאז. | ||
| - | <br /> | ||
| - | בעלי חיים, צמחים וגם חלק מהחיידקים מייצרים עמילאז. | ||
| - | |||
| - | <br /> | ||
| - | קוֹפָקְטוֹר (גורם משלים) הוא חלק לא חלבוני באנזים החיוני לפעולתו של האנזים על הסובסטרט. קופקטורים יכולים להיות מלחים או | ||
| - | ויטמינים. מחסור בחומרים אלו מונע את פעילות האנזים. | ||
| - | |||
| - | לעמילאז ישנם שני קופקטורים, | ||
| - | <scene name='User:Amir_Mitchell/hebrew_amylase/Clzoom/1'> אטום כלור </scene> ו | ||
| - | <scene name='User:Amir_Mitchell/hebrew_amylase/Cazoom/1'>אטום סידן</scene> | ||
| - | המזרזים את תהליך פירוק הסובסטרט. | ||
| - | <br /> | ||
| - | |||
</p> | </p> | ||
| - | <p dir='rtl'> | ||
| - | pH דרוש לפעילות העמילאז קרוב לניטראלי ,6.8 עד 7.0 ,בדומה לpH השורר בנוזל הרוק ובחלל הפה . | ||
<br /> | <br /> | ||
| - | + | [[Image:F3.large.jpg|left|400px|thumb|Mechanism]] | |
| - | + | Cysteine-scanning Mutagenesis of Muscle | |
| - | + | Carnitine Palmitoyltransferase I Reveals a Single Cysteine Residue (Cys-305) Is Important for Catalysis* | |
| - | + | HongYan Liu‡§, Guolu Zheng‡¶, Michelle Treber, Jia Dai and Gebre Woldegiorgis∥ | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
Current revision
_
|
Contents |
CPT1 פלמיטיל קרנטין טרנספרז
תפקיד
חלק מקומפלכס שאחראי על העברת חומצות שומן דרך מימברנת המיטוכונדריה ,כדי לאפשר חמצון חומצות השומן
להפקת אנרגיה.
.אנזים זה מאפשר להחליף את הקואנזים הקשור לחומצת השומן ,בקרנטין
מבנה
האנזים בנוי משתי תת יחידות שזהות בקיפולן. האתר הפעיל נמצא בתווך שבין שתי תת היחידות ומכיל שלש חומצות אמינו שכנראה משתתפות במנגנון הקטליזה.היסטידין בעמדה 473 , חומצה אספרטית בעמדה 454 וציסטאין בעמדה 304
מנגנון קטליזה
האנזים פוגש את חומצת השומן שמחוברת לקואנזים . בתחילה (בשלב 1+2 בשרטוט) ,בעזרת שני השיירים, ציסטאין בעמדה 304 ,והיסטידין בעמדה 473, הקואנזים -חומצת השומן, מתפרק כך שחומצת השומן ניקשרת לציסטיאן והקואנזים ניקשר להיסטידין. הקישור להיסטידין מתאפשר בעזרת האינטראקציה בן השייר של החומצה האספרטית בעמדה 454 וההיסטדין. בהמשך (שלבים 3+4 בשרטוט) הקואנזים משתחרר והקרנטין מתחבר לפחמן הקרבונילי של חומצת השומן שמחוברת עדיין לאנזים דרך ציסטאין בעמדה 304 בשלב האחרון חומצת השומן-קרנטין משתחררים מהאנזים . השייר של חומצת האמינו ציסטאין יוצר אינטראקציה חדשה עם היסטדין 473
Cysteine-scanning Mutagenesis of Muscle Carnitine Palmitoyltransferase I Reveals a Single Cysteine Residue (Cys-305) Is Important for Catalysis* HongYan Liu‡§, Guolu Zheng‡¶, Michelle Treber, Jia Dai and Gebre Woldegiorgis∥