Insulin Receptor - kinase domain (Hebrew)
From Proteopedia
| (20 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
| - | ==<center>''' | + | ==<center>'''החלק התוך תאי של הקולטן לאינסולין'''</center>== |
| - | < | + | <br> |
| + | ==<div style="text-align: right; direction: ltr; margin-left: 1em;">'''כללי'''</div>== | ||
| + | |||
<p dir='rtl'> | <p dir='rtl'> | ||
הקולטן לאינסולין הוא חלק ממשפחה גדולה של קולטנים המכונים: [http://en.wikipedia.org/wiki/Receptor_tyrosine_kinase רצפטור טירוזין קינאז (RTK)] . קולטנים אלו נמצאים על גבי ממברנת התאים והם מתווכים מעבר של מסרים מחוץ לתא פנימה. מעבר אותות שכזה מתאפשר הודות [http://proteopedia.org/wiki/images/c/c9/RTK.jpg למבנה הקולטנים] שכולל חלק חוץ-תאי, חלק חוצה ממברנה וחלק תוך-תאי שהוא בעל פעילות של טירוזין קינאז (אנזים שמוסיף לחלבוני-מטרה קבוצת פוספט נקרא קינאז. אנזים שמוסיף את הפוספט לחומצת אמינו טירוזין בחלבון המטרה נקרא טירוזין-קינאז) . | הקולטן לאינסולין הוא חלק ממשפחה גדולה של קולטנים המכונים: [http://en.wikipedia.org/wiki/Receptor_tyrosine_kinase רצפטור טירוזין קינאז (RTK)] . קולטנים אלו נמצאים על גבי ממברנת התאים והם מתווכים מעבר של מסרים מחוץ לתא פנימה. מעבר אותות שכזה מתאפשר הודות [http://proteopedia.org/wiki/images/c/c9/RTK.jpg למבנה הקולטנים] שכולל חלק חוץ-תאי, חלק חוצה ממברנה וחלק תוך-תאי שהוא בעל פעילות של טירוזין קינאז (אנזים שמוסיף לחלבוני-מטרה קבוצת פוספט נקרא קינאז. אנזים שמוסיף את הפוספט לחומצת אמינו טירוזין בחלבון המטרה נקרא טירוזין-קינאז) . | ||
| Line 15: | Line 17: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
מסלול שני אחראי על גדילה והתמיינות של תאים באמצעות בקרת הביטוי של גנים מסוימים. | מסלול שני אחראי על גדילה והתמיינות של תאים באמצעות בקרת הביטוי של גנים מסוימים. | ||
| - | + | </p> | |
| - | + | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | ==<div style="text-align: right; direction: ltr; margin-left: 1em;">'''מבנה הקולטן'''</div>== | |
| - | + | </p> | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
<p dir='rtl'> | <p dir='rtl'> | ||
הקולטן מורכב משני מונומרים שכל אחד מהם מורכב משתי שרשרות - [http://proteopedia.org/wiki/images/e/e8/Alpha_beta.jpg אלפא ובטא] - המחוברות ביניהן בקשרי s-s. הקינאז פעיל רק כששני מונומרים של הקולטן מחוברים יחד (יוצרים קשרי s-s בין שרשרות האלפא שלהם) ויוצרים [http://proteopedia.org/wiki/images/d/da/Ss.png דימר]. שרשרת אלפא (קצה N) של כל מונומר מכילה את החלק החוץ-תאי שקושר את הליגנד, ואילו שרשרת בטא (קצה C) מכילה את החלק התוך-תאי בעל הפעילות של הטירוזין קינאז. | הקולטן מורכב משני מונומרים שכל אחד מהם מורכב משתי שרשרות - [http://proteopedia.org/wiki/images/e/e8/Alpha_beta.jpg אלפא ובטא] - המחוברות ביניהן בקשרי s-s. הקינאז פעיל רק כששני מונומרים של הקולטן מחוברים יחד (יוצרים קשרי s-s בין שרשרות האלפא שלהם) ויוצרים [http://proteopedia.org/wiki/images/d/da/Ss.png דימר]. שרשרת אלפא (קצה N) של כל מונומר מכילה את החלק החוץ-תאי שקושר את הליגנד, ואילו שרשרת בטא (קצה C) מכילה את החלק התוך-תאי בעל הפעילות של הטירוזין קינאז. | ||
</p> | </p> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | מבין שלושת חלקי הקולטן, שכולם שמורים אבולוציונית, החלק התוך-תאי (הטירוזין קינאז) הוא בעל רמת השימור הגבוהה ביותר. | + | מבין שלושת חלקי הקולטן, שכולם שמורים אבולוציונית, החלק התוך-תאי (הטירוזין קינאז) הוא בעל [http://proteopedia.org/wiki/images/9/9b/%D7%A4%D7%A8%D7%95%D7%98%D7%90%D7%95%D7%A4%D7%93%D7%99%D7%94_%D7%A9%D7%99%D7%9E%D7%95%D7%A8_%281%29.pdf רמת השימור הגבוהה ביותר]. |
</p> | </p> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | ==<div style="text-align: right; direction: ltr; margin-left: 1em;">'''(מבנה החלק התוך-תאי (הטירוזין קינאז'''</div>== | |
| + | <Structure load='1IR3' size='350' frame='true' align='left' caption= | ||
| + | 'מבנה מרחבי של אזור תוך-תאי של הקולטן לאינסולין שהוא בעל פעילות של טירוזין קינאז. (בחלק מהסצנות מופיעים, בנוסף לאנזים, גם אנלוג של ,יוני מגנזיום וחלבון-מטרה קטן). בכל הסצנות מופיע אותו אזור, לעיתים בשלמותו ולעיתים בחלקו. הקולטן לאינסולין הוא דימר, אולם כאן מוצג חלק תוך-תאי של אחד משני המונומרים הזהים בלבד' scene='70/702914/N-c/1' /> | ||
</p> | </p> | ||
| - | ==<center>'''(מבנה החלק התוך-תאי (הטירוזין קינאז'''</center>== | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | הערך הזה מציג את המבנה של חלק משרשרת בטא של מונומר אחד. זהו חלק תוך-תאי של הקולטן, בעל פעילות של טירוזין קינאז. הוא מוצג כאן כאשר הוא קשור ל<scene name='70/702914/Only_atp_analog_in_pro1/1'>אנלוג של ATP</scene> ול<scene name='70/702914/B_chain_without_water1/1'>חלבון-מטרה</scene> בן 18 חומצות אמינו, שעתיד לעבור זירחון על-ידו (חלבון המטרה מסומן בכחול, יוני מגנזיום שככל הנראה נדרשו לצורך הגיבוש מופיעים בירוק. אך האם תוכלו לזהות גם את האנלוג של ATP?). | |
</p> | </p> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | הטירוזין קינאז הוא חלק בן 306 <scene name='70/702914/Amino_acids12/1'>חומצות אמינו</scene> (כל סוג חומצת אמינו צבוע בצבע אחר). <scene name='70/702914/Secondary_structure1/1'>כאן מוצג המבנה השניוני</scene> שלו (בוורוד- אלפא הליקס, בצהוב- משטחי בטא) . | |
</p> | </p> | ||
| - | + | ==<div style="text-align: right; direction: ltr; margin-left: 1em;">'''אופן פעולת האנזים'''</div>== | |
| + | <p dir='rtl'> | ||
| + | עיקרון הפעולה של האנזים הוא: זירחון עצמי כתוצאה מקישור של ליגנד, ובעקבותיו זירחון של חלבוני מטרה (דוגמת "insulin receptor substrate 1"-"IRS-1") שממשיכים את שרשרת מעבר האותות בתוך התא. הן הזרחון העצמי של האנזים והן הזירחון של חלבוני המטרה על-ידו מתרחש על-גבי שיירים של חומצות האמינו [http://proteopedia.org/wiki/images/9/9b/Tyr_and_ptyr.png טירוזין] של כל חלבון. | ||
</p> | </p> | ||
| - | ==<center>'''אופן פעולת האנזים'''</center>== | ||
<p dir='rtl'> | <p dir='rtl'> | ||
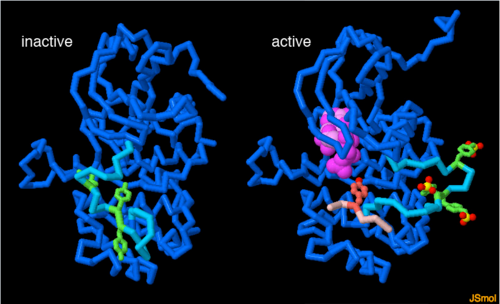
| - | + | האנזים פעיל, כאמור, רק כשהקולטן הוא בצורת דימר, ורק כשישנו קישור של ליגנד לחלק החוץ-תאי שלו. לאחר קישור של ליגנד לחלק החוץ-תאי מתרחש זירחון עצמי של חומצות אמינו <scene name='70/702914/Ptyr_in_loop_best_black_1/1'>טירוזין בעמדות ספציפיות</scene> בחלק התוך-תאי של הקולטן. חומצות האמינו האלו הן חלק ממבנה טבעתי [http://proteopedia.org/wiki/images/1/1c/Shimur1.png שמור מאד] המכונה Activation loop (או בקיצור: A-loop), אשר "יושב" בתוך האתר הפעיל של האנזים וחוסם את פעילותו כל זמן שאין קישור של ליגנד. ברגע שיש קישור של ליגנד ומתרחש זירחון עצמי של חומצות האמינו האלו, הטבעת "יוצאת" מהאתר הפעיל. [[Image:Active inactive.png | 500px|right|thumb]] | |
</p> | </p> | ||
| + | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | האנזים פעיל, | + | כאן אפשר לראות תמונה של האנזים הלא-פעיל- כאשר הטבעת חוסמת את האתר הפעיל שלו, ושל האנזים הפעיל- לאחר שהטבעת יצאה. בתכלת- הטבעת, בירוק- חומצות אמינו טירוזין בטבעת שעוברות זירחון עצמי (הזכרנו אותן קודם). כעת יכולים להיכנס לאתר הפעיל [http://proteopedia.org/wiki/images/8/8e/Atp.jpg מולקולת ATP] וחלבון-מטרה, ואז יתרחש זירחון שלו (כלומר- האנזים יעביר לחלבון המטרה זרחן מה- ATP). גם בחלבון המטרה הזרחן יתווסף לחומצות אמינו טירוזין . |
</p> | </p> | ||
| - | + | <br> | |
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | [http://proteopedia.org/wiki/images/c/c1/%D7%93%D7%A3_%D7%A2%D7%91%D7%95%D7%93%D7%94.doc דף עבודה] | |
</p> | </p> | ||
| - | This is a default text for your page '''Insulin Receptor - kinase domain (hebrew)'''. Click above on '''edit this page''' to modify. Be careful with the < and > signs. | ||
| - | You may include any references to papers as in: the use of JSmol in Proteopedia <ref>DOI 10.1002/ijch.201300024</ref> or to the article describing Jmol <ref>PMID:21638687</ref> to the rescue. | ||
| - | <br | ||
| - | <br | ||
| - | <scene name='70/702914/Secondary_structure/2'>מבנה שניוני</scene> | ||
| - | == Disease == | ||
| - | == Relevance == | ||
| - | == Structural highlights == | ||
| - | + | ||
== References == | == References == | ||
| + | https://en.wikipedia.org/wiki/Receptor_tyrosine_kinase | ||
| + | |||
| + | http://www.rcsb.org/pdb/explore/explore.do?structureId=1ir3 | ||
| + | |||
| + | http://emboj.embopress.org/content/16/18/5572.long | ||
| + | |||
| + | http://www.uniprot.org/uniprot/P06213 | ||
| + | |||
| + | http://www.rcsb.org/pdb/101/motm.do?momID=182 | ||
| + | |||
| + | http://www.ncbi.nlm.nih.gov/protein/P06213.4 | ||
| + | |||
<references/> | <references/> | ||
Current revision
Contents |
החלק התוך תאי של הקולטן לאינסולין
כללי
הקולטן לאינסולין הוא חלק ממשפחה גדולה של קולטנים המכונים: רצפטור טירוזין קינאז (RTK) . קולטנים אלו נמצאים על גבי ממברנת התאים והם מתווכים מעבר של מסרים מחוץ לתא פנימה. מעבר אותות שכזה מתאפשר הודות למבנה הקולטנים שכולל חלק חוץ-תאי, חלק חוצה ממברנה וחלק תוך-תאי שהוא בעל פעילות של טירוזין קינאז (אנזים שמוסיף לחלבוני-מטרה קבוצת פוספט נקרא קינאז. אנזים שמוסיף את הפוספט לחומצת אמינו טירוזין בחלבון המטרה נקרא טירוזין-קינאז) .
קישור של ליגנד (במקרה הזה-בעיקר אינסולין) לחלק החוץ-תאי גורם להפעלה של הקינאז, וכתוצאה מכך לשרשרת תגובות תוך תאיות ראו איור.
כאשר מדובר בקולטן לאינסולין לתגובה התוך-תאית יש שני מסלולים עיקריים:
מסלול אחד אחראי על רוב הפעילות המטבולית של אינסולין ומוביל, בין היתר, למעבר נשאים של גלוקוז מהציטופלזמה אל ממברנת התא. כתוצאה מכך גדלה כניסת הגלוקוז לתאים.
מסלול שני אחראי על גדילה והתמיינות של תאים באמצעות בקרת הביטוי של גנים מסוימים.
מבנה הקולטן
הקולטן מורכב משני מונומרים שכל אחד מהם מורכב משתי שרשרות - אלפא ובטא - המחוברות ביניהן בקשרי s-s. הקינאז פעיל רק כששני מונומרים של הקולטן מחוברים יחד (יוצרים קשרי s-s בין שרשרות האלפא שלהם) ויוצרים דימר. שרשרת אלפא (קצה N) של כל מונומר מכילה את החלק החוץ-תאי שקושר את הליגנד, ואילו שרשרת בטא (קצה C) מכילה את החלק התוך-תאי בעל הפעילות של הטירוזין קינאז.
מבין שלושת חלקי הקולטן, שכולם שמורים אבולוציונית, החלק התוך-תאי (הטירוזין קינאז) הוא בעל רמת השימור הגבוהה ביותר.
(מבנה החלק התוך-תאי (הטירוזין קינאז
|
הערך הזה מציג את המבנה של חלק משרשרת בטא של מונומר אחד. זהו חלק תוך-תאי של הקולטן, בעל פעילות של טירוזין קינאז. הוא מוצג כאן כאשר הוא קשור ל ול בן 18 חומצות אמינו, שעתיד לעבור זירחון על-ידו (חלבון המטרה מסומן בכחול, יוני מגנזיום שככל הנראה נדרשו לצורך הגיבוש מופיעים בירוק. אך האם תוכלו לזהות גם את האנלוג של ATP?).
הטירוזין קינאז הוא חלק בן 306 (כל סוג חומצת אמינו צבוע בצבע אחר). שלו (בוורוד- אלפא הליקס, בצהוב- משטחי בטא) .
אופן פעולת האנזים
עיקרון הפעולה של האנזים הוא: זירחון עצמי כתוצאה מקישור של ליגנד, ובעקבותיו זירחון של חלבוני מטרה (דוגמת "insulin receptor substrate 1"-"IRS-1") שממשיכים את שרשרת מעבר האותות בתוך התא. הן הזרחון העצמי של האנזים והן הזירחון של חלבוני המטרה על-ידו מתרחש על-גבי שיירים של חומצות האמינו טירוזין של כל חלבון.
האנזים פעיל, כאמור, רק כשהקולטן הוא בצורת דימר, ורק כשישנו קישור של ליגנד לחלק החוץ-תאי שלו. לאחר קישור של ליגנד לחלק החוץ-תאי מתרחש זירחון עצמי של חומצות אמינו בחלק התוך-תאי של הקולטן. חומצות האמינו האלו הן חלק ממבנה טבעתי שמור מאד המכונה Activation loop (או בקיצור: A-loop), אשר "יושב" בתוך האתר הפעיל של האנזים וחוסם את פעילותו כל זמן שאין קישור של ליגנד. ברגע שיש קישור של ליגנד ומתרחש זירחון עצמי של חומצות האמינו האלו, הטבעת "יוצאת" מהאתר הפעיל.
כאן אפשר לראות תמונה של האנזים הלא-פעיל- כאשר הטבעת חוסמת את האתר הפעיל שלו, ושל האנזים הפעיל- לאחר שהטבעת יצאה. בתכלת- הטבעת, בירוק- חומצות אמינו טירוזין בטבעת שעוברות זירחון עצמי (הזכרנו אותן קודם). כעת יכולים להיכנס לאתר הפעיל מולקולת ATP וחלבון-מטרה, ואז יתרחש זירחון שלו (כלומר- האנזים יעביר לחלבון המטרה זרחן מה- ATP). גם בחלבון המטרה הזרחן יתווסף לחומצות אמינו טירוזין .
References
https://en.wikipedia.org/wiki/Receptor_tyrosine_kinase
http://www.rcsb.org/pdb/explore/explore.do?structureId=1ir3
http://emboj.embopress.org/content/16/18/5572.long
http://www.uniprot.org/uniprot/P06213
http://www.rcsb.org/pdb/101/motm.do?momID=182
http://www.ncbi.nlm.nih.gov/protein/P06213.4