Myosin (hebrew)
From Proteopedia
(Difference between revisions)
| (15 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
==<center> הראש המוטורי-II מיוזין </center>== | ==<center> הראש המוטורי-II מיוזין </center>== | ||
| - | <StructureSection load='1BR1' size='340' side='right' caption=' | + | <StructureSection load='1BR1' size='340' side='right' caption='Chicken myosin motor domain light chain complex with ADP (PDB code [[1br1]]).' scene='84/846751/Myosin_2/1'> |
| Line 34: | Line 34: | ||
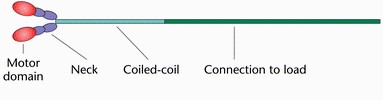
כל [https://he.wikipedia.org/wiki/%D7%9E%D7%95%D7%9C%D7%A7%D7%95%D7%9C%D7%94 מולקולת] חלבון מיוזין בנויה משני "ראשים" ו"זנב" אחד ארוך במבנה צר. <scene name='84/846751/All_chains_together/2'>כפי שניתן לראות בהדמיה </scene> (רואים חלק קטן מהזנבות) המיוזין מסודר בצורה של סיב, כאשר מספר מולקולות מלופפות באזור זנבותיהן והראשים פונים לכיוונים מנוגדים. | כל [https://he.wikipedia.org/wiki/%D7%9E%D7%95%D7%9C%D7%A7%D7%95%D7%9C%D7%94 מולקולת] חלבון מיוזין בנויה משני "ראשים" ו"זנב" אחד ארוך במבנה צר. <scene name='84/846751/All_chains_together/2'>כפי שניתן לראות בהדמיה </scene> (רואים חלק קטן מהזנבות) המיוזין מסודר בצורה של סיב, כאשר מספר מולקולות מלופפות באזור זנבותיהן והראשים פונים לכיוונים מנוגדים. | ||
| - | ה"זנב" מורכב | + | ה"זנב" מורכב משתי שרשראות של [https://he.wikipedia.org/wiki/%D7%97%D7%95%D7%9E%D7%A6%D7%AA_%D7%90%D7%9E%D7%99%D7%A0%D7%95 חומצות אמיניות] המאורגנות כל אחת במבנה של [https://he.wikipedia.org/wiki/%D7%A1%D7%9C%D7%99%D7%9C_%D7%90%D7%9C%D7%A4%D7%90 אלפא הליקס]. השרשראות מלופפות זו על זו במבנה סליל כפול (בדומה למבנה ה[https://he.wikipedia.org/wiki/DNA דנ"א]) ניתן לראות את .<scene name='84/846751/All_chains_together_secondary/1'>המבנה השניוני של חלבון המיוזין השלם</scene> (ורוד מסמל אלפא הליקס, צהוב מסמל משטחי בטא) |
| - | ה"ראשים" נמצאים בקצה המולקולה ובהם מתקיימות | + | ה"ראשים" נמצאים בקצה המולקולה ובהם מתקיימות שתי פעולות המשמשות כמעין מנוע מולקולרי הממיר אנרגיה כימית לארגיה מכנית:<br> |
א. פעילות ATPase : פירוק מולקולת ATP ל ADP+Pi. <br> | א. פעילות ATPase : פירוק מולקולת ATP ל ADP+Pi. <br> | ||
| Line 49: | Line 49: | ||
[[Image:מיוזין 1.jpg|center]]<br> | [[Image:מיוזין 1.jpg|center]]<br> | ||
| - | <center>'''בעמוד זה נתמקד במבנה <scene name='84/846751/Motor_domain/4'>הראש המוטורי של המיוזין</scene> (האזור שבצבע | + | <center>'''בעמוד זה נתמקד במבנה <scene name='84/846751/Motor_domain/4'>הראש המוטורי של המיוזין</scene> (האזור שבצבע אדום באיור) אזור זה מורכב מ 820 <scene name='84/846751/Amino_acid/4'>חומצות אמיניות</scene><br> ''' </center> |
| Line 64: | Line 64: | ||
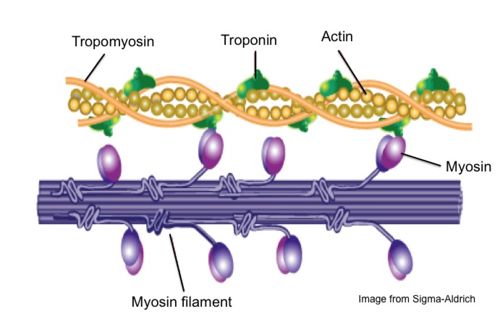
על מנת שחלבון המיוזין יבצע את פעילותו המוטורית עליו להיקשר לסיב האקטין. | על מנת שחלבון המיוזין יבצע את פעילותו המוטורית עליו להיקשר לסיב האקטין. | ||
| - | הקשר בין מולקולות האקטין למיוזין מתבצע באזור ה"ראשים" של מולקולות המיוזין, | + | הקשר בין מולקולות האקטין למיוזין מתבצע באזור ה"ראשים" של מולקולות המיוזין, בשני <scene name='84/846751/Actin_binding_site/6'>אתרי קישור לאקטין</scene><br>: האתר הראשון מורכב מ - 13 חומצות אמינו (667-689), רובן פולריות, היוצרות קשרי מימן. האתר השני מורכב מ - 15 חומצות אמינו (768-782), רובן פולריות וטעונות חיובית, היוצרות [https://he.wikipedia.org/wiki/קשר_מימן קשרי מימן] ו[https://he.wikipedia.org/wiki/%D7%A7%D7%A9%D7%A8_%D7%99%D7%95%D7%A0%D7%99 קשרים יוניים].<ref> |
[https://www.ncbi.nlm.nih.gov/protein/P10587/ מידע על החלבון מיוזין מתוך NCBI]</ref> | [https://www.ncbi.nlm.nih.gov/protein/P10587/ מידע על החלבון מיוזין מתוך NCBI]</ref> | ||
כפי שניתן לראות <scene name='84/846751/Actin_binding_site_polar/3'>בהדמיה</scene> (כחול- חומצה טעונה חיובית)<br><br> | כפי שניתן לראות <scene name='84/846751/Actin_binding_site_polar/3'>בהדמיה</scene> (כחול- חומצה טעונה חיובית)<br><br> | ||
| - | |||
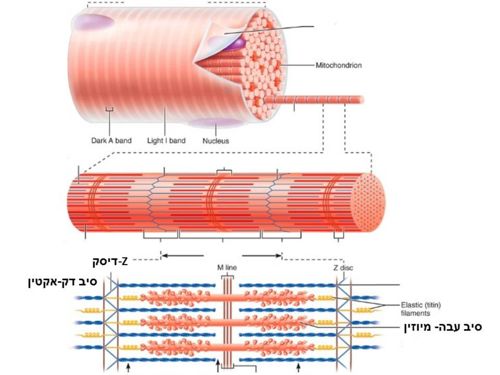
| - | בשריר המשורטט (שרירי השלד), מולקולות המיוזין יוצרות מבנה של סיב עבה המכיל 300-400 מולקולות (המקנה לאזור צבע כהה), ולצידו אזור של מולקולות אקטין היוצרות מבנה של סיב דק (מקנה לאזור צבע בהיר). האזור הבהיר מכונה "Z-disc". | ||
| - | בקצוות המבנה הקוטבי בולטים "ראשים" של המיוזין הפונים לכיוונים מנוגדים, והאזור המרכזי של המבנה אינו מכיל "ראשים".<br> | ||
| - | |||
| Line 97: | Line 93: | ||
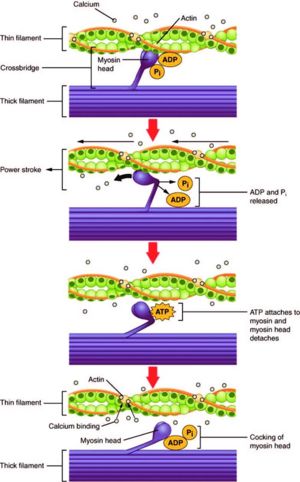
| - | <scene name='84/846751/Atp_binding_site/ | + | <scene name='84/846751/Atp_binding_site/4'>ניתן לראות את אתרי הקישור לATP</scene><br><br> |
3"דרוך" (cocked) – בשלב השלישי מתרחשת [https://he.wikipedia.org/wiki/%D7%94%D7%99%D7%93%D7%A8%D7%95%D7%9C%D7%99%D7%96%D7%94 הידרוליזה] של מולקולת ATP המחוברת לראש המיוזין. תוצרי ההידרוליזה (ADP+Pi) נשארים קשורים ל"ראש" המולקולה, ובכך גורמים למעין פעולת דריכה, בדומה לדריכה בכלי ירייה.<br> | 3"דרוך" (cocked) – בשלב השלישי מתרחשת [https://he.wikipedia.org/wiki/%D7%94%D7%99%D7%93%D7%A8%D7%95%D7%9C%D7%99%D7%96%D7%94 הידרוליזה] של מולקולת ATP המחוברת לראש המיוזין. תוצרי ההידרוליזה (ADP+Pi) נשארים קשורים ל"ראש" המולקולה, ובכך גורמים למעין פעולת דריכה, בדומה לדריכה בכלי ירייה.<br> | ||
| - | <scene name='84/846751/Atp_binding_site_nucleotide/ | + | <scene name='84/846751/Atp_binding_site_nucleotide/5'>ניתן לראות את אתרי הקישור הנפרדים של הפוספט (סגול) וADP(כתום)</scene><br><br> |
4 "הפעלת כוח" (force generating) - בשלב הרביעי, שחרור תוצר ההידרוליזה (Pi) גורם לחיזוק ההתקשרות בין האקטין למיוזין ולהתגבשות המבנה המשותף בכוחות דחיפה ודחיסה.<ref> | 4 "הפעלת כוח" (force generating) - בשלב הרביעי, שחרור תוצר ההידרוליזה (Pi) גורם לחיזוק ההתקשרות בין האקטין למיוזין ולהתגבשות המבנה המשותף בכוחות דחיפה ודחיסה.<ref> | ||
| Line 109: | Line 105: | ||
[https://davidson.weizmann.ac.il/online/maagarmada/med_and_physiol/%D7%9E%D7%A0%D7%92%D7%A0%D7%95%D7%9F-%D7%A4%D7%A2%D7%95%D7%9C%D7%AA-%D7%94%D7%A9%D7%A8%D7%99%D7%A8 מנגנון פעולת השריר- מכון דוידסון]</ref><br> | [https://davidson.weizmann.ac.il/online/maagarmada/med_and_physiol/%D7%9E%D7%A0%D7%92%D7%A0%D7%95%D7%9F-%D7%A4%D7%A2%D7%95%D7%9C%D7%AA-%D7%94%D7%A9%D7%A8%D7%99%D7%A8 מנגנון פעולת השריר- מכון דוידסון]</ref><br> | ||
| - | בהדמיה זו ניתן לראות את <scene name='84/846751/Binding_sytes/ | + | בהדמיה זו ניתן לראות את <scene name='84/846751/Binding_sytes/5'>כל אתרי הקישור בראש המוטורי של המיוזין</scene> (כחול-קישור לאקטין, ורוד-קישור לפוספט, כתום-קישור לADP)<br><br> |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| Line 134: | Line 126: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
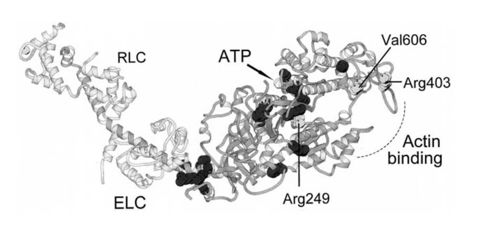
| - | [https://he.wikipedia.org/wiki/%D7%9E%D7%95%D7%98%D7%A6%D7%99%D7%94 מוטציות] רבות ב[https://he.wikipedia.org/wiki/%D7%92%D7%9F_(%D7%91%D7%99%D7%95%D7%9C%D7%95%D7%92%D7%99%D7%94) גנים] המקודדים ל motor domain עלולות לגרום לקשיים בתפקוד תקין של פעולת השרירים. למשל, מוטציות באזור הקשירה לאקטין ובאזור הקישור לATP ב[https://he.wikipedia.org/wiki/%D7%A9%D7%A8%D7%99%D7%A8_%D7%94%D7%9C%D7%91 שריר הלב] עלולות לגרום לFamilial hypertrophic cardiomyopathy, מחלה תורשתית בה נגרמת התעבות של שריר זה. ההתעבות גורמת לשאיבת ה[https://he.wikipedia.org/wiki/%D7%93%D7%9D דם] להתרחש בצורה לא יעילה ואף להוביל ל[https://he.wikipedia.org/wiki/%D7%90%D7%95%D7%98%D7%9D_%D7%A9%D7%A8%D7%99%D7%A8_%D7%94%D7%9C%D7%91 התקף לב]. | + | [https://he.wikipedia.org/wiki/%D7%9E%D7%95%D7%98%D7%A6%D7%99%D7%94 מוטציות] רבות ב[https://he.wikipedia.org/wiki/%D7%92%D7%9F_(%D7%91%D7%99%D7%95%D7%9C%D7%95%D7%92%D7%99%D7%94) גנים] המקודדים ל motor domain עלולות לגרום לקשיים בתפקוד תקין של פעולת השרירים. למשל, מוטציות באזור הקשירה לאקטין ובאזור הקישור לATP ב[https://he.wikipedia.org/wiki/%D7%A9%D7%A8%D7%99%D7%A8_%D7%94%D7%9C%D7%91 שריר הלב] עלולות לגרום לFamilial hypertrophic cardiomyopathy, מחלה תורשתית בה נגרמת התעבות של שריר זה. ההתעבות גורמת לשאיבת ה[https://he.wikipedia.org/wiki/%D7%93%D7%9D דם] להתרחש בצורה לא יעילה ואף להוביל ל[https://he.wikipedia.org/wiki/%D7%90%D7%95%D7%98%D7%9D_%D7%A9%D7%A8%D7%99%D7%A8_%D7%94%D7%9C%D7%91 התקף לב]. |
| - | נמצא כי המוטציות כוללות שינוי בחומצות אמינו יחידות הסמוכות לאתרי הקישור לאקטין | + | נמצא כי המוטציות כוללות שינוי בחומצות אמינו יחידות הסמוכות לאתרי הקישור לאקטין ול ATP באתרים הבאים |
| - | (Val 606,Arg 403, Arg 249) גורמות לשיבוש במבנה המרחבי של המיוזין אשר גורם לפעילות לא תקינה של השריר. | + | (Val 606,Arg 403, Arg 249) |
| + | גורמות לשיבוש במבנה המרחבי של המיוזין אשר גורם לפעילות לא תקינה של השריר.<br> | ||
| + | ניתן לראות באיור את מיקום המוטציות הנקודתיות הגורמות למחלה: | ||
<ref>Roopnarine, Osha, and Leslie A. Leinwand. "Functional analysis of myosin mutations that cause familial hypertrophic cardiomyopathy." Biophysical journal 75.6 (1998): 3023-3030. | <ref>Roopnarine, Osha, and Leslie A. Leinwand. "Functional analysis of myosin mutations that cause familial hypertrophic cardiomyopathy." Biophysical journal 75.6 (1998): 3023-3030. | ||
| Line 144: | Line 138: | ||
[[Image:Mutation myosin.jpg|thumb|500px|center|מוטציות נקודתיות באזור הראש המוטורי של המיוזין]] | [[Image:Mutation myosin.jpg|thumb|500px|center|מוטציות נקודתיות באזור הראש המוטורי של המיוזין]] | ||
| - | |||
| - | |||
</StructureSection> | </StructureSection> | ||
| - | <scene name='84/846751/ | + | <scene name='84/846751/All_chains_together/2'>שני ראשי מיוזין מחוברים באזור הצוואר ועם זנבות מלופפים</scene><br> |
| + | <scene name='84/846751/All_chains_together_secondary/1'>מבנה שניוני של חלבון המיוזין השלם</scene><br> | ||
| + | <scene name='84/846751/Motor_domain/4'>הראש המוטורי</scene><br> | ||
<scene name='84/846751/Amino_acid/4'>חומצות אמיניות</scene><br> | <scene name='84/846751/Amino_acid/4'>חומצות אמיניות</scene><br> | ||
<scene name='84/846751/Actin_binding_site/6'>אתר הקישור לאקטין</scene><br> | <scene name='84/846751/Actin_binding_site/6'>אתר הקישור לאקטין</scene><br> | ||
| - | <scene name='84/846751/Atp_binding_site/3'>ATP אתר הקישור ל</scene><br> | ||
| - | <scene name='84/846751/Atp_binding_site_nucleotide/3'>ATPאתר קישור של נוקלאוטידים ו</scene><br> | ||
| - | <scene name='84/846751/Evolutionary_changes/1'>אזור שמורים אבולוציונית בחלבון</scene><br> | ||
| - | <scene name='84/846751/Binding_sytes/4'>כל אתרי הקישור של המיוזין</scene><br> | ||
| - | <scene name='84/846751/Myosin_mutation/2'>מוטציות נקודתיות</scene><br> | ||
| - | <scene name='84/846751/All_chains_together/2'>שני ראשי מיוזין מחוברים באזור הצוואר ועם זנבות מלופפים</scene><br> | ||
<scene name='84/846751/Actin_binding_site_polar/3'>פולריות באתר קישור לאקטין</scene><br> | <scene name='84/846751/Actin_binding_site_polar/3'>פולריות באתר קישור לאקטין</scene><br> | ||
| - | <scene name='84/846751/ | + | <scene name='84/846751/Atp_binding_site/4'>ATP אתר הקישור ל</scene><br> |
| - | <scene name='84/846751/ | + | <scene name='84/846751/Atp_binding_site_nucleotide/5'>ATPאתר קישור של נוקלאוטידים ו</scene><br> |
| + | <scene name='84/846751/Binding_sytes/5'>כל אתרי הקישור של המיוזין</scene><br> | ||
| + | |||
| + | |||
| + | |||
| + | == דף עבודה לתלמיד == | ||
| + | |||
| + | |||
| + | [https://forms.gle/eeBeSmmxG9AKMAH59 דף עבודה מבנה המיוזין] | ||
| + | |||
| + | |||
== References == | == References == | ||
Current revision
הראש המוטורי-II מיוזין
| |||||||||||
דף עבודה לתלמיד
References
- ↑ שלד התא - מכון דוידסון
- ↑ השלד התוך תאי - המחלקה להוראת המדעים מכון ויצמן
- ↑ מידע על מיוזין מויקיפדיה
- ↑ מידע על החלבון מיוזין מתוך NCBI
- ↑ מידע על החלבון מיוזין מתוך NCBI
- ↑ מידע על מיוזין מויקיפדיה
- ↑ מנגנון פעולת השריר- מכון דוידסון
- ↑ Roopnarine, Osha, and Leslie A. Leinwand. "Functional analysis of myosin mutations that cause familial hypertrophic cardiomyopathy." Biophysical journal 75.6 (1998): 3023-3030.