Human Insulin Degrading Enzyme (Hebrew)
From Proteopedia
| (3 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | <StructureSection load='6B7Y' size='350' side='left' caption='אנזים מפרק האינסולין - דימר המורכב משתי מונומרים.' scene='84/846755/Overview/7'> | + | <StructureSection load='6B7Y' size='350' side='left' caption=' [[6b7y]] אנזים מפרק האינסולין - דימר המורכב משתי מונומרים.' scene='84/846755/Overview/7'> |
<p dir='rtl'> | <p dir='rtl'> | ||
| Line 30: | Line 30: | ||
<br> | <br> | ||
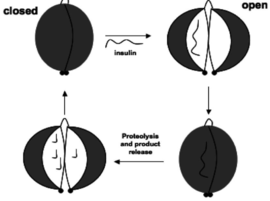
פקטור נוסף שעושה רגולציה על המעבר מקונפורמציה פתוחה וסגורה היא רמת ה-ATP בתא. | פקטור נוסף שעושה רגולציה על המעבר מקונפורמציה פתוחה וסגורה היא רמת ה-ATP בתא. | ||
| - | כחלק מהרגולציה על פעילות החלבון, נקשרת מולקולת ATP <scene name='84/846755/Atp_binding_site/ | + | כחלק מהרגולציה על פעילות החלבון, נקשרת מולקולת ATP <scene name='84/846755/Atp_binding_site/5'>לעמדה 429</scene> המופיעה בכתום. בעמדה זו מופיעה החומצה האמינית ארגינין והיא שמורה אבולוציונית. הקישור של הATP לחלבון מוביל לתעדוף של הקונפורמציה הפתוחה החיונית לפעילות הקטאליטית וליצירת תצמיד אנזים-סובסטרט. כאשר רמות ה-ATP בתא גבוהות, משמעות הדבר היא שמתבצעת נשימה תאית בקצב גבוהה, כלומר, רמת הסוכר בתאים כבר גבוהה. לכן, על מנת לשמור על ההומאוסטזיס בזרם הדם ושלא תהיה היפוגליקמיה,המתאפיינת ברמת גלוקוז נמוכה בדם, יש תעדוף לפירוק של אינסולין, וזאת כדי שפחות גלוקוז יוכל להיכנס לתאים לאורך זמן ורמת הסוכר בדם לא תחרוג מן הטווח ההומאוסטטי (בין 80-110 מיליגרם/דציליטר דם). |
<br> | <br> | ||
<br> | <br> | ||
| - | האנזים מפרק אינסולין נחשב למטאלופרוטאז, בהיותו מזרז את ריאקציית [https://www.youtube.com/watch?v=H9VTB41jgLI ההידרוליזה] של פפטידים באמצעות שימוש ביוני אבץ. ישנן שלוש <scene name='84/846755/Metal_binding_sites/ | + | האנזים מפרק אינסולין נחשב למטאלופרוטאז, בהיותו מזרז את ריאקציית [https://www.youtube.com/watch?v=H9VTB41jgLI ההידרוליזה] של פפטידים באמצעות שימוש ביוני אבץ. ישנן שלוש <scene name='84/846755/Metal_binding_sites/4'>עמדות קישור</scene> המסומנות בבורדו (108 ,112 ,190) ליון המתכת אבץ Zn+2, משמע ששלושת האתרים הללו משתתפים יחד בקשירה של יון אבץ אחד לכל מונומר, ויחד הם מהווים חלק מהאתר הפעיל הפרוטאוליטי בכל אחד מהמונומרים המרכיבים את הדימר. בכל העמדות הללו מופיעה החומצה האמינית היסטידין (H)המכילה בשייר שלה קבוצה המכונה [https://en.wikipedia.org/wiki/Imidazole אימידזול] אשרה יכולה לקשור יוני מתכת (כדוגמת אבץ וניקל) בקשרים לא קוולנטים. עמדות אלו שמורות מבחינה אבולוציונית. |
בסמיכות רבה לעמדות קושרות האבץ נמצא האתר הפעיל בעמדה 111, שם מתבצע הביקוע של הסובסטרט. | בסמיכות רבה לעמדות קושרות האבץ נמצא האתר הפעיל בעמדה 111, שם מתבצע הביקוע של הסובסטרט. | ||
למרות שרב הנסתר על הגלוי באשר למכניזם שמסביר את הקטליזה אותה מבצע האנזים, נמצא כי [https://he.wikipedia.org/wiki/%D7%A7%D7%99%D7%A0%D7%98%D7%99%D7%A7%D7%94_%D7%90%D7%A0%D7%96%D7%99%D7%9E%D7%98%D7%99%D7%AA שלב קובע מהירות] מותנה [https://he.wikipedia.org/wiki/%D7%94%D7%AA%D7%9E%D7%A8%D7%94_%D7%A0%D7%95%D7%A7%D7%9C%D7%90%D7%95%D7%A4%D7%99%D7%9C%D7%99%D7%AA התקפה נוקלאופילית] שמתרחשת כאשר יוני האבץ עוברים לסובסטרט. | למרות שרב הנסתר על הגלוי באשר למכניזם שמסביר את הקטליזה אותה מבצע האנזים, נמצא כי [https://he.wikipedia.org/wiki/%D7%A7%D7%99%D7%A0%D7%98%D7%99%D7%A7%D7%94_%D7%90%D7%A0%D7%96%D7%99%D7%9E%D7%98%D7%99%D7%AA שלב קובע מהירות] מותנה [https://he.wikipedia.org/wiki/%D7%94%D7%AA%D7%9E%D7%A8%D7%94_%D7%A0%D7%95%D7%A7%D7%9C%D7%90%D7%95%D7%A4%D7%99%D7%9C%D7%99%D7%AA התקפה נוקלאופילית] שמתרחשת כאשר יוני האבץ עוברים לסובסטרט. | ||
Current revision
| |||||||||||
References
1. Affholter JA, Fried VA, Roth RA (December 1988). "Human insulin-degrading enzyme shares structural and functional homologies with E. coli protease III". Science. 242 (4884): 1415–8.
2. Farris W, Mansourian S, Chang Y, Lindsley L, Eckman EA, Frosch MP, et al. (April 2003). "Insulin-degrading enzyme regulates the levels of insulin, amyloid beta-protein, and the beta-amyloid precursor protein intracellular domain in vivo". Proceedings of the National Academy of Sciences of the United States of America. 100 (7): 4162–7.
3. Hulse RE, Ralant LA, Tang WJ (February 2009). "Structure, Function, and Regulation of Insulin-Degrading Enzyme". Vitamins & Hormones 80:635-48. doi: 10.1016/S0083-6729(08)00622-5
4. Kerr ML, Small DH (April 2005). "Cytoplasmic domain of the beta-amyloid protein precursor of Alzheimer's disease: function, regulation of proteolysis, and implications for drug development". Journal of Neuroscience Research. 80 (2): 151–9. doi:10.1002/jnr.20408. PMID 15672415.
5. Kurochkin IV, Goto S (May 1994). "Alzheimer's beta-amyloid peptide specifically interacts with and is degraded by insulin degrading enzyme". FEBS Letters. 345 (1): 33–7. doi:10.1016/0014-5793(94)00387-4. PMID 8194595.
6. Mirsky IA, Broh-Kahn RH (January 1949). "The inactivation of insulin by tissue extracts; the distribution and properties of insulin inactivating extracts". Archives of Biochemistry. 20 (1): 1–9. PMID 18104389.
7.Wang DS, Dickson DW, Malter JS (2006). "beta-Amyloid degradation and Alzheimer's disease". Journal of Biomedicine & Biotechnology. 2006 (3): 58406. doi:10.1155/JBB/2006/58406. PMC 1559921. PMID 17047308.
8. https://www.ncbi.nlm.nih.gov/sites/entrez?Db=gene&Cmd=ShowDetailView&TermToSearch=3416
9. https://www.uniprot.org/uniprot/P14735
10. https://www.rcsb.org/structure/6b7y