Beta-galactosidase (hebrew)
From Proteopedia
(Difference between revisions)
| (48 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
==<center>'''בטא-גלקטוזידאז'''</center>== | ==<center>'''בטא-גלקטוזידאז'''</center>== | ||
| - | <StructureSection load=' | + | <StructureSection load='1dp0' size='340' side='left' caption='Caption for this structure scene ='89/898980/Protein/1'> |
| - | + | <p dir='rtl'> | |
| - | + | </p> | |
| - | == <center>''' | + | == <center>'''מבוא'''</center> == |
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | בטא גלקטוזידאז הוא אנזים הקיים בחיידקי E.coli, ובאורגניזמים רבים אחרים, האחראי על פירוק לקטוז (דו סוכר המורכב מגלוקוז ופרוקטוז). | + | בטא-גלקטוזידאז הוא אנזים הקיים בחיידקי ''E.coli'', ובאורגניזמים רבים אחרים, האחראי על פירוק לקטוז (דו סוכר המורכב מגלוקוז ופרוקטוז). |
<br> | <br> | ||
חד סוכרים אלו מהווים מקורות אנרגיה לחיידק (החיידק מפרק אותם בתהליך | חד סוכרים אלו מהווים מקורות אנרגיה לחיידק (החיידק מפרק אותם בתהליך | ||
| - | [https://www.jove.com/embed/player?id=10737&access=j9gou5mhsf&t=1&s=1&fpv=1 גליקוליזה)] | + | [https://www.jove.com/embed/player?id=10737&access=j9gou5mhsf&t=1&s=1&fpv=1 גליקוליזה)]. |
| - | + | ||
| - | + | ||
| - | + | ||
<br> | <br> | ||
| - | האנזים בטא גלקטוזידאז מבצע 3 פעולות שמביאות בסופו של דבר לפירוק הלקטוז לגלוקוז וגלקטוז: | + | בחיידקי ''E.coli'', האנזים הוא תוצר של הגן lacZ |
| + | שהינו חלק | ||
| + | [https://www.britannica.com/science/operon מאופרון] | ||
| + | הלקטוז. רצף האופרון וארגון הגנים בו התגלו ב-1961. | ||
| + | <br> | ||
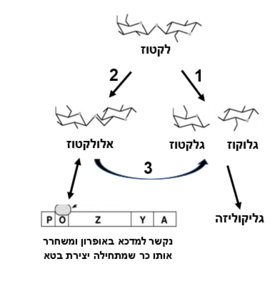
| + | האנזים בטא-גלקטוזידאז מבצע 3 פעולות שמביאות בסופו של דבר לפירוק הלקטוז לגלוקוז וגלקטוז (ראה איור 1): | ||
<br> | <br> | ||
- ביקוע הלקטוז לגלקטוז+גלוקוז | - ביקוע הלקטוז לגלקטוז+גלוקוז | ||
| Line 22: | Line 24: | ||
- המרת הלקטוז לאלולקטוז | - המרת הלקטוז לאלולקטוז | ||
<br> | <br> | ||
| - | - הידרוליזה | + | - הידרוליזה של אלולקטוז לגלקטוז+גלוקוז |
<br> | <br> | ||
| - | לתוצר אלולקטוז יש תפקיד בבקרה הגנטית על בטאגלקטוזידאז (ראה פסקה על אופרון הלקטוז) | + | לתוצר אלולקטוז יש תפקיד בבקרה הגנטית על בטאגלקטוזידאז (ראה פסקה על אופרון הלקטוז) <ref> Douglas H.Juers, Raymond H.Jacobson, Dale Wigley, Xue-Jun Zhang, Reuben E.Huber, Dale E.Tronrud and Brian W.Matthews (2000) , ''High resolution refinement of b-galactosidase in a new crystal form reveals multiple metal-binding sites and provides a structural basis for a-complementation'', Protein Science 9:1685–1699. Cambridge University Press. Printed in the USA |
| + | https://pubmed.ncbi.nlm.nih.gov/11045615/ </ref> <ref name="Douglas h. juers"> Douglas H. Juers, Brian W. Matthews, and Reuben E. Huber, | ||
| + | ''LacZ b-galactosidase: Structure and function of an enzyme of historical and molecular biological importance'', Protein Sci 2012 Dec;21(12):1792-807. doi: 10.1002/pro.2165. Epub 2012 Nov 13. | ||
| + | https://pubmed.ncbi.nlm.nih.gov/23011886/ </ref> | ||
</p> | </p> | ||
<br> | <br> | ||
| - | [[Image:Beta.PNG|thumb|center|פעולת האנזים]] | + | [[Image:Beta.PNG|thumb|center|280px|איור 1: פעולת האנזים]] |
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | הגן המקודד לאנזים בטא גלקטוזידאז נמצא גם בגנום של בני אדם (הרבה פעמים האנזים המקודד על ידי גן זה מכונה: לקטאז). | + | הגן המקודד לאנזים בטא-גלקטוזידאז נמצא גם בגנום של בני אדם (הרבה פעמים האנזים המקודד על ידי גן זה מכונה: לקטאז). |
| + | גן זה מתבטא בעיקר בתקופת הינקות. | ||
<br> | <br> | ||
| - | + | אצל רוב בני האדם (כ-70%) פעילות האנזים הולכת ופוחתת לאחר תקופה זו כיוון שרמת הביטוי שלו יורדת, | |
| + | דבר הגורם להרבה אנשים לבטא אי סבילות ללקטוז (כיוון שהלקטוז לא מתפרק). | ||
<br> | <br> | ||
| - | + | בנוסף, בקרב אחוז קטן של אנשים באוכלוסייה, ישנה אי סבילות ללקטוז הנובעת מחסר מולד באנזים (מוטציה בגן לבטא-גלקטוזידאז). | |
<br> | <br> | ||
חברות מזון שונות מוסיפות את האנזים, המופק מאורגנזימים שונים, למזונות המכילים לקטוז כדי שהאנזים יפרק את הלקטוז | חברות מזון שונות מוסיפות את האנזים, המופק מאורגנזימים שונים, למזונות המכילים לקטוז כדי שהאנזים יפרק את הלקטוז | ||
וכך גם אנשים בעלי אי סבילות ללקטוז יכולים להנות ממזונות אלה. | וכך גם אנשים בעלי אי סבילות ללקטוז יכולים להנות ממזונות אלה. | ||
<br> | <br> | ||
| - | לאחרונה נחקר האנזים כטיפול אפשרי לאי-סבילות ללקטוז על ידי ריפוי גני, בהחדרת הגן לאנזים זה ל-DNA, על מנת שאנשים החסרים לקטאז יוכלו לבקע לקטוז בדרך זו. | + | לאחרונה נחקר האנזים כטיפול אפשרי לאי-סבילות ללקטוז הנובעת מחסר באנזים, על ידי [https://he.wikipedia.org/wiki/%D7%A8%D7%99%D7%A4%D7%95%D7%99_%D7%92%D7%A0%D7%99 ריפוי גני] , בהחדרת הגן לאנזים זה ל-DNA, על מנת שאנשים החסרים לקטאז יוכלו לבקע לקטוז בדרך זו.<ref> בטא-גלקטוזידאז באתר ויקירפואה:[https://www.wikirefua.org.il/w/index.php/%D7%91%D7%98%D7%90-%D7%92%D7%9C%D7%A7%D7%98%D7%95%D7%96%D7%99%D7%93%D7%90%D7%96_-_Beta-galactosidase#.D7.AA.D7.A8.D7.97.D7.99.D7.A9.D7.99.D7.9D_.D7.A7.D7.9C.D7.99.D7.A0.D7.99.D7.99.D7.9D_.D7.91.D7.97.D7.A1.D7.A8_.D7.94.D7.90.D7.A0.D7.96.D7.99.D7.9D]</ref> |
</p> | </p> | ||
| - | == | + | == <center>'''אופרון הלקטוז'''</center> == |
| + | <br> | ||
| + | <p dir='rtl'> | ||
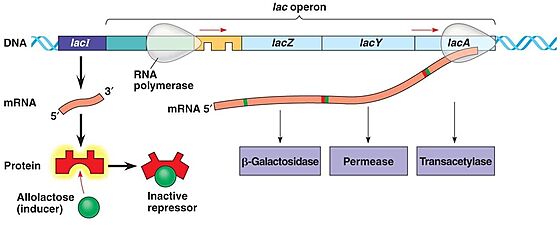
| + | מאחר ולקטוז הוא לא מקור האנרגיה המועדף על החיידק ''E.coli'' הוא לא מנצל אותו כמקור אנרגיה בתנאים בהם קיימים בסביבתו מקורות אנרגיה עדיפים. היות ותהליך יצירת החלבונים הוא תהליך צורך אנרגיה, על החיידק לבטא את החלבונים המפרקים לקטוז רק כאשר הלקטוז משמש כמקור ההזנה שלו. בהיעדר לקטוז, תופעל בקרה גנטית אשר תמנע ייצור מיותר של האנזים. | ||
| + | <br> | ||
| + | מבנה אופרון הלקטוז: | ||
| + | <br> | ||
| + | אופרון הלקטוז כולל 3 גנים מבניים, ושני רצפי DNA בקרתיים : פרומוטור ואופרטור (כמפורט מטה). בנוסף, הבקרה על שעתוק האופרון מצריכה מעורבות של חלבון הקרוי רפרסור. | ||
| + | <br> | ||
| + | חלבון זה מבוטא מגן הקרוי LacI המצוי בגנום בסמיכות לאופרון הלקטוז. | ||
| + | <br> | ||
| + | '''Lac Z'''- גן שמקודד ל-β-galactosidase – אנזים שמפרק לקטוז לגלוקוז ולגלקטוז | ||
| + | <br> | ||
| + | '''Lac Y'''- גן שמקודד ל-β-galactosidase permease, נשא שמאפשר ללקטוז להיכנס אל התא. | ||
| + | <br> | ||
| + | '''Lac A'''- גן שמקודד לאנזים טראנסאצטילאז שמסייע בניצול הלקטוז. | ||
| + | <br> | ||
| + | '''פרומוטור (אתר מקדם)''': מקטע דנ"א שנמצא לפני האופרון ואחראי על גיוס ה-RNA polymerase לשעתוק הגנים המבניים. | ||
| + | <br> | ||
| + | '''Lac I'''- גן המקודד לחלבון רפרסור, דכאן. | ||
| + | <br> | ||
| + | '''רפרסור (דכאן):''' חלבון שהקשירה שלו לאופרטור מעכבת את הביטוי של הגן. | ||
| + | <br> | ||
| + | '''אופרטור (אתר מפעיל)''': אתר קשירה לחלבון הרפרסור (דכאן) | ||
| + | <br> | ||
| + | '''אינדוסר (משרן)''': מולקולת אלולקטוז שהיא אחד מתוצרי הפירוק של הלקטוז, משמשת כמשרן בתהליך. | ||
| + | <br> | ||
| + | <br> | ||
| + | '''בקרה שלילית באופרון הלקטוז-''' | ||
| + | <br> | ||
| + | כאשר חלבון הרפרסור נקשר לאתר האופרטור, הוא מונע את קשירתו של האנזים RNA polymerase לאתר הפרומוטור וכך נמנע תעתוק האופרון. כאשר מגדלים את החיידק על מצע לקטוז, הלקטוז מפורק על-ידי מעט האנזימים המתבטאים ברמה נמוכה ונוצר אלולקטוז. | ||
| + | אלולקטוז נקשר לחלבון הרפרסור, משנה את מבנהו המרחבי ומסיר אותו מהאופרטור. זה מאפשר את קשירת RNA polymerase לפרומוטור ומתבצע תעתוק של האופרון. | ||
| + | (ראה איור 2) <ref> אופרון הלקטוז באתר דוידסון אונליין: [https://davidson.weizmann.ac.il/online/tikshuv/life_sci/%D7%91%D7%A7%D7%A8%D7%94-%D7%92%D7%A0%D7%98%D7%99%D7%AA-%D7%90%D7%95%D7%A4%D7%A8%D7%95%D7%9F-%D7%94%D7%9C%D7%A7%D7%98%D7%95%D7%96] </ref> <ref> יהודית עתידיה (2001), ''גנטיקה'', האוניברסיטה העברית, משרד החינוך ומטה מל"מ. 171-174</ref> | ||
| + | </p> | ||
| + | <br> | ||
| + | [[Image:Lactose operon.jpg|thumb|center|560px|איור 2: אופרון הלקטוז]] | ||
| - | == | + | == <center>'''מבנה הבטא-גלקטוזידאז'''</center> == |
| + | <br> | ||
| + | <p dir='rtl'> | ||
| + | החלבון בטא-גלאקטוזידאז מהאורגניזם ''E.coli'' הינו הומוטטרמר שמורכב מ<scene name='89/898980/Four_monomer_of_the_protein/2'>ארבעה מונומרים זהים</scene>,כל מונומר מורכב מ- 1023 <scene name='89/898980/Amino_acid/1'>חומצות אמיניות.</scene> | ||
| + | בסצנת החומצות האמיניות ניתן לראות כי כל חומצה אמינית צבועה בצבע שונה. | ||
| + | <br> | ||
| + | ישנם ארבעה אתרים פעילים, <scene name='89/898980/Active_site1/1'>אתר פעיל אחד</scene> בכל מונומר.כאשר האנזים פעיל, יכולות להיקשר אליו ארבע מולוקולת של לקטוז, אחת בכל אתר פעיל. | ||
| + | <br> | ||
| + | האתרים הפעילים פועלים באופן עצמאי, אך פעילותם תלויה במבנה התקין של הטטרמר. | ||
| + | ישנו אזור בכל מונומר הקריטי לחיבורם לכדי טטרמר פעיל. כאשר אזור זה חסר, מתקבל אנזים לא פעיל. | ||
| + | <br> | ||
| + | הוספת המקטע החסר, תרכיב מחדש את האנזים הפעיל. הוספה כזו נקראת השלמת אלפא (ראה פסקה שימוש במחקר והנדסה גנטית). | ||
| + | <br> | ||
| + | פעילות האנזים תלויה גם בקשירת נתרן ואשלגן בעמדות מסוימות של החלבון (עמדות אלה שמורות באבולוציה, ז"א מופיעות בבטא-גלקטוזידאז של אורגניזמים שונים. ראה פסקה הבאה). | ||
| + | <br> | ||
| + | ישנם מספר <scene name='89/898980/Mg_and_na/1'>יוני נתרן ומגנזיום</scene> הקשורים לחומצות אמיניות שונות בחלבון. תפקידם ככל הנראה לאפשר ייצוב של המבנה המרחבי של כל אחד משני הדימרים המרכיבים את הטטרמר, | ||
| + | <br> | ||
| + | ביניהם <scene name='89/898980/Active_site_mg/1'>יון מגנזיום הקשור באתר הפעיל</scene> (צבוע בצבע אדום )מאפשר פעילות מיטבית של האנזים. <ref name="Douglas h. juers"/> <ref name="NCBI"> https://www.ncbi.nlm.nih.gov/protein/P00722.2 חלבון בטא-גלקטוזידאז - NCBI </ref> | ||
| + | <br> | ||
| + | </p> | ||
| - | == | + | == <center>''' בטא-גלקטוזידאז בראי האבולוציה'''</center> == |
| - | < | + | |
<br> | <br> | ||
| - | < | + | <p dir='rtl'> |
| + | דמיון ברצפי DNA וחלבונים לאורך האבולוציה מעיד על חשיבות החלבון (או איזור בחלבון) לתפקוד האורגניזמים. | ||
<br> | <br> | ||
| - | + | הצטברות מוטציות לאורך האבולוציה הביאה לשינויים גנטיים מהותיים אשר איפשרו יצירה של מגוון רחב של יצורים, השונים גנטית זה מזה. | |
<br> | <br> | ||
| - | + | אזורים בעלי חשיבות פחותה לתפקוד חלבון מסוים מציגים שינויים גנטיים גדולים יותר בין אורגניזם אחד לאחר. | |
<br> | <br> | ||
| - | < | + | עם זאת, בחלבונים שונים ניתן לראות עמדות ששמורות לאורך האבולוציה, גם בין יצורים רחוקים אבולוציונית זה מזה. |
| + | <br> | ||
| + | העובדה שאותן עמדות שמורות ביצורים שרחוקים אבולוציונית זה מזה, מעידה על חשיבות העמדות אלו לתפקוד או קיפול החלבון. | ||
<br> | <br> | ||
| - | <scene name='89/898980/ | + | במבנה האנזים בטא-גלקטוזידאז יש מספר אתרים החשובים לתפקודו. |
| + | <br> | ||
| + | בהשוואת רצפים של החלבון מאורגניזמים שונים מצביעה על מספר <scene name='89/898980/Saved_positions_in_evolution/1'>עמדות שמורות לאורך האבולוציה</scene>. | ||
| + | לדוגמא: החומצות האמיניות בעמדות 102,201,604, 461 ו- 537 שמהוות את <scene name='89/898980/Active_site_plus/1'>האתר הפעיל ואתרים לקשירת הסובסטרט</scene>. | ||
<br> | <br> | ||
| - | + | ניתן להשוות עמדות שמורות באבולוציה באמצעות עימוד רצפים בכלים ביואינפורמטים שונים כמו | |
| + | clustalw. | ||
<br> | <br> | ||
| - | <scene name='89/898980/ | + | כל פסקה מציגה עימוד בין 9 אורגניזמים נבחרים. שם האורגניזם כתוב בעמודה השלישית משמאל, ואחריו רצף חומצות האמיניות של אותו אורגניזם בחלבון מסוים. |
| + | <br> | ||
| + | '''עמדות שמורות בכל האורגניזמים''' שנבדקו: מסומנות ב- * | ||
| + | <br> | ||
| + | '''עמדות שמורות ברוב האורגניזמים אך לא בכולם''': מסומנות ב- : | ||
| + | <br> | ||
| + | '''עמדות לא שמורות''': ללא סימון | ||
| + | <br> | ||
| + | הדוגמא באיור 3 מציגה עימוד של האנזים בטא-גלקטוזידאז בחיידקים שונים, בהשוואה לחיידק | ||
| + | ''E.coli'', אשר נמצא בשורה הראשונה. '''עמדות שמורות המסומנות באדום''' הן עמדות חשובות בתפקוד החלבון. <ref name="NCBI"/> <ref> https://www.rcsb.org/structure/1DP0 מבנה החלבון בטא-גלקטוזידאז - PDB </ref> | ||
| + | [[Image:Imud.PNG|thumb|center|560px|איור 3: תוצאות עימוד בטא-גלקטוזידאז]] | ||
| + | </p> | ||
| + | |||
| + | == <center>'''שימוש במחקר והנדסה גנטית'''</center> == | ||
| + | <br> | ||
| + | <p dir='rtl'> | ||
| + | שתי תגליות בנוגע לאנזים אפשרו את השימוש בו לצרכי מחקר: | ||
| + | <br> | ||
| + | 1.'''האנזים מאוד ספציפי לגלקטוז אך פחות לגלוקוז''', ולכן אפשר לגדל תאים בנוכחות גלקטוז שמחובר לחומר אחר, כך שנוצר חומר שהוא אנלוג ללקטוז והאנזים עדיין יפרק אותו. אחד מהחומרים האלה, X-gal, מכיל צבע שהופך לכחול כשהוא מופרד מהגלקטוז. | ||
| + | <br> | ||
| + | 2.'''השלמת אלפא'''- ניתן להשבית את פעילות האנזים על ידי הסרת פפטיד מסוים (<scene name='89/898980/Alpha_comlementation/1'>פפטיד אלפא</scene>) מהמבנה השלם ולהפעילו מחדש על ידי שילוב הפפטיד שנשאר (פפטיד אומגה) עם פפטידים משלימים שכוללים את פפטיד אלפא. | ||
| + | <br> | ||
| + | המדענים משתמשים בשתי התגליות הללו כדי לעקוב אחר תהליכים המתרחשים בחיידקים מהונדסים: | ||
| + | <br> | ||
| + | '''שימוש כגן מבחין''' | ||
| + | <br> | ||
| + | בשיטת מעקב זו הגן לאנזים משמש כגן מבחין המאפשר להבדיל בין חיידקים שקלטו | ||
| + | [https://davidson.weizmann.ac.il/online/maagarmada/technology/%D7%94%D7%A4%D7%9C%D7%A1%D7%9E%D7%99%D7%93-%D7%9B%D7%90%D7%9E%D7%A6%D7%A2%D7%99-%D7%9C%D7%94%D7%A0%D7%93%D7%A1%D7%94-%D7%92%D7%A0%D7%98%D7%99%D7%AA פלסמיד] | ||
| + | משובט, לבין חיידקים שקלטו פלמיד שאינו משובט. | ||
| + | <br> | ||
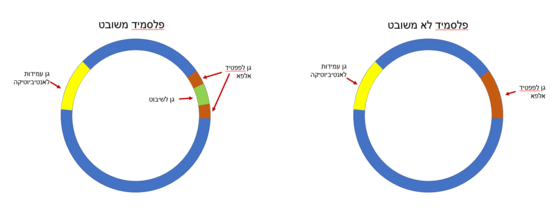
| + | השיטה: מכינים חיידקים ללא עמידות לאנטיביוטיקה שהגנום שלהם מכיל גן מוטנטי, המקודד לפפטיד אומגה בלבד (שאינו פעיל ללא פפטיד אלפא). | ||
| + | <br> | ||
| + | מכינים פלסמיד שהוחדר אליו גן לעמידות לאנטיביוטיקה באזור אחד וגן לפפטיד אלפא (שאינו פעיל ללא פפטיד אומגה) באזור אחר. לתוך אזור הגן לפפטיד אלפא מחדירים את המקטע שאותו רוצים לשבט, כך שהוא "מפריע" לתעתוק הגן לפפטיד אלפא (ראה איור 4). | ||
| + | <br> | ||
| + | מחדירים את הפלסמידים לחיידקים שהוכנו (חסרי הגן לפפטיד אלפא) ואת החיידקים זורעים על מצע שמכיל את ה X-gal ואת האנטיביוטיקה הרלוונטית. | ||
| + | </p> | ||
| + | [[Image:Plasmid beta.PNG|thumb|center|560px|איור 4: שימוש כגן מבחין- פלסמיד משובט לעומת פלסמיד לא משובט]] | ||
| + | <br> | ||
| + | <p dir='rtl'> | ||
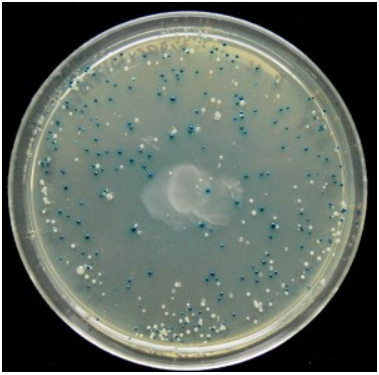
| + | בדיקת המצע תלמד על הצלחת החדרת המקטע לשיבוט: מושבות חיידקים כחולות יעידו על כישלון השיבוט (משמעות הצבע הכחול היא שנוצר פפטיד אלפא שהשלים את פפטיד גמא ויצר אנזים פעיל שפרק את ה X-gal שבמצע ויצר את הצבע הכחול). | ||
| + | <br> | ||
| + | מושבות חיידקים לבנות יעידו על הצלחת השיבוט (משמעות הצבע הלבן היא שלא נוצר פפטיד אלפא ולכן האנזים אינו פעיל ולא נגרם פירוק של ה X-gal במצע). | ||
| + | <br> | ||
| + | העובדה שהתפתחו מושבות על גבי המצע, הכולל אנטיביוטיקה, שוללת אפשרות לטעון שמה שנכשל הוא החדרת הפלסמיד כיוון שתכונת העמידות לאנטיביוטיקה הוחדרה באמצעות הפלסמיד. <ref name="Douglas h. juers"/> | ||
| + | </p> | ||
| + | <br> | ||
| + | <p dir='rtl'> | ||
| + | '''שימוש כגן מדווח''' | ||
| + | <br> | ||
| + | בשיטה זו בודקים את הבקרה על ביטוי של גנים. | ||
| + | <br> | ||
| + | משבטים את הגן לבטא גלקטוזידאז המלא במורד הזרם מפרומוטור שאת דגם ביטויו רוצים לבדוק. | ||
| + | <br> | ||
| + | לאחר חשיפה ל X-gal ניתן לראות באילו תנאים או מצבים הגן מתבטא, מה שמעיד על פרומוטור פעיל. | ||
| + | <br> | ||
| + | מושבות כחולות יעידו על תאים בהם הפרומוטור פעיל ומושבות לבנות יעידו על פרומוטור מושתק.(ראה איור 5) | ||
| + | </p> | ||
| + | [[Image:X gal.PNG|thumb|center|560px|איור 5: שימוש כגן מדווח, מתוך ויקיפדיה]] | ||
<br> | <br> | ||
| - | < | + | ==<center>'''דף עבודה לתלמיד'''</center>== |
| - | + | <center>[https://proteopedia.org/wiki/images/8/8c/%D7%93%D7%A3_%D7%A2%D7%91%D7%95%D7%93%D7%94_%D7%91%D7%98%D7%90-%D7%92%D7%9C%D7%A7%D7%98%D7%95%D7%96%D7%99%D7%93%D7%90%D7%96_%D7%9C%D7%AA%D7%9C%D7%9E%D7%99%D7%93.pdf דף עבודה לתלמיד]</center> | |
</StructureSection> | </StructureSection> | ||
| - | == | + | == <center>''' מקורות מידע '''</center> == |
<references/> | <references/> | ||
Current revision
בטא-גלקטוזידאז
| |||||||||||
מקורות מידע
- ↑ Douglas H.Juers, Raymond H.Jacobson, Dale Wigley, Xue-Jun Zhang, Reuben E.Huber, Dale E.Tronrud and Brian W.Matthews (2000) , High resolution refinement of b-galactosidase in a new crystal form reveals multiple metal-binding sites and provides a structural basis for a-complementation, Protein Science 9:1685–1699. Cambridge University Press. Printed in the USA https://pubmed.ncbi.nlm.nih.gov/11045615/
- ↑ 2.0 2.1 2.2 Douglas H. Juers, Brian W. Matthews, and Reuben E. Huber, LacZ b-galactosidase: Structure and function of an enzyme of historical and molecular biological importance, Protein Sci 2012 Dec;21(12):1792-807. doi: 10.1002/pro.2165. Epub 2012 Nov 13. https://pubmed.ncbi.nlm.nih.gov/23011886/
- ↑ בטא-גלקטוזידאז באתר ויקירפואה:[1]
- ↑ אופרון הלקטוז באתר דוידסון אונליין: [2]
- ↑ יהודית עתידיה (2001), גנטיקה, האוניברסיטה העברית, משרד החינוך ומטה מל"מ. 171-174
- ↑ 6.0 6.1 https://www.ncbi.nlm.nih.gov/protein/P00722.2 חלבון בטא-גלקטוזידאז - NCBI
- ↑ https://www.rcsb.org/structure/1DP0 מבנה החלבון בטא-גלקטוזידאז - PDB