Cytochrome C (Hebrew)
From Proteopedia
(Difference between revisions)
| (41 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
| - | ==<center>''' C ציטוכרום'''</center>== | + | ==<center>'''אנושי C ציטוכרום'''</center>== |
<p dir='rtl'> | <p dir='rtl'> | ||
| - | ציטוכרום C הוא חלבון קטן (משקלו המולקולרי כ-12,000 דלטון) שמור מאוד לאורך האבולוציה ומצוי בצמחים, בבעלי חיים ובאורגניזמים חד-תאיים רבים. לחלבון קשורה קבוצת הם ובמרכזה אטום ברזל. | + | ציטוכרום C הוא חלבון קטן (משקלו המולקולרי כ-12,000 דלטון) שמור מאוד לאורך האבולוציה ומצוי בצמחים, בבעלי חיים ובאורגניזמים חד-תאיים רבים. לחלבון קשורה קבוצת [https://he.wikipedia.org/wiki/%D7%94%D7%9D הם] ובמרכזה אטום ברזל. חלבון מפתח בשרשרת הולכת האלקטרונים ובתהליך האפופטוזיס (מוות מבוקר של התא). |
</p> | </p> | ||
| - | <StructureSection load='1J3S' size='340' side='left' caption='C ציטוכרום' scene='89/898985/Cytochrome_c_basic/19'> | + | <StructureSection load='1J3S' size='340' side='left' caption=' אנושי C ציטוכרום (PDB code [[1j3s]])' scene='89/898985/Cytochrome_c_basic/19'> |
==<div style="text-align: right;">מבוא </div> == | ==<div style="text-align: right;">מבוא </div> == | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | ציטוכרום C הינו חלבון מפתח בשרשרת הולכת האלקטרונים. תהליך זה הינו השלב האחרון בתהליך הנשימה התאית. כזכור את הנשימה התאית ניתן לחלק לשלושה שלבים מרכזיים: גליקוליזה (מתרחשת בציטופלזמה), מעגל קרבס (מתרחש בתוך המרחב הפנימי של המיטוכונדריה) ושרשרת הולכת האלקטרונים המתרחשת על-גבי הממברנה הפנימית של המיטוכונדריה. בתהליך שרשרת הולכת האלקטרונים מולקולות המחוזרות במעגל קרבס כמו FADH2 ו-NADH נוטות להעביר אלקטרונים למולקולות איתם הם נמצאות במגע. בכך נוצרת שרשרת של חלבונים נושאי אלקטרונים. האלקטרונים נקלטים בסופו של דבר על ידי אטומי חמצן אטמוספירי המתרכבים יחד ליצירת מים מטבוליים. כתוצאה מהולכת האלקטרונים בין הנשאים השונים, מועברים יוני מימן מהמרחב הפנימי של המיטוכונדריה לתוך המרווח הבין קרומי של המיטוכונדריה . באמצעות מפל ריכוזים של יוני המימן נוצרת האנרגיה הפוטנציאלית לייצור ATP על ידי החלבון ATP סינתאז. | + | ציטוכרום C הינו חלבון מפתח בשרשרת הולכת האלקטרונים. תהליך זה הינו השלב האחרון בתהליך [https://he.wikipedia.org/wiki/%D7%A0%D7%A9%D7%99%D7%9E%D7%94_%D7%AA%D7%90%D7%99%D7%AA הנשימה התאית]. כזכור את הנשימה התאית ניתן לחלק לשלושה שלבים מרכזיים: [https://he.wikipedia.org/wiki/%D7%92%D7%9C%D7%99%D7%A7%D7%95%D7%9C%D7%99%D7%96%D7%94 גליקוליזה] (מתרחשת בציטופלזמה), [https://he.wikipedia.org/wiki/%D7%9E%D7%A2%D7%92%D7%9C_%D7%A7%D7%A8%D7%91%D7%A1 מעגל קרבס] (מתרחש בתוך המרחב הפנימי של המיטוכונדריה) ושרשרת הולכת האלקטרונים המתרחשת על-גבי הממברנה הפנימית של המיטוכונדריה. בתהליך שרשרת הולכת האלקטרונים מולקולות המחוזרות במעגל קרבס כמו FADH2 ו-NADH נוטות להעביר אלקטרונים למולקולות איתם הם נמצאות במגע. בכך נוצרת שרשרת של חלבונים נושאי אלקטרונים. האלקטרונים נקלטים בסופו של דבר על ידי אטומי חמצן אטמוספירי המתרכבים יחד ליצירת מים מטבוליים. כתוצאה מהולכת האלקטרונים בין הנשאים השונים, מועברים יוני מימן מהמרחב הפנימי של המיטוכונדריה לתוך המרווח הבין קרומי של המיטוכונדריה . באמצעות מפל ריכוזים של יוני המימן נוצרת האנרגיה הפוטנציאלית לייצור ATP על ידי החלבון ATP סינתאז. [https://he.wikipedia.org/wiki/ATP ATP] הינה מולקולה עתירת אנרגיה המאפשרת את פעילותם של אנזימים רבים ושל תהליכים רבים ומגוונים בתא. כדי לשמור על רמה גבוהה של ATP הגוף נדרש לייצר אותו כל העת במיטוכונדריה. לכן, מעבר האלקטרונים ויצירת מפל ריכוזים של יוני מימן הינו תהליך מפתח לקיום תקין של התא. |
<br> | <br> | ||
<br> | <br> | ||
| - | [[Image:Electron_transport_chain_cytochrome_c.jpg|border|600px|]] | + | תמונה 1 (על מנת לצפות בהסבר על התמונות בערך הניחו את העכבר על התמונה הרצויה וההסבר יצוף) |
| - | + | </p> | |
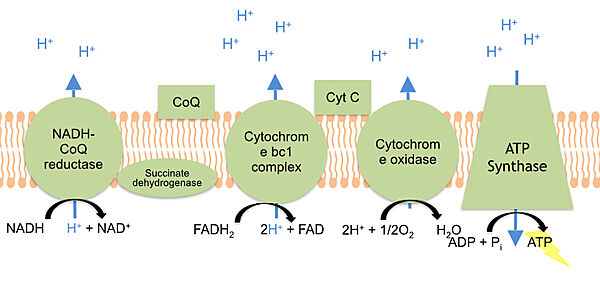
| + | [[Image:Electron_transport_chain_cytochrome_c.jpg|border|center|600px|בתמונה מוצגת שרשרת הולכת האלקטרונים - כתוצאה מהולכת האלקטרונים בין הנשאים השונים, מועברים יוני מימן מהמרחב הפנימי | ||
| + | של המיטוכונדריה לתוך המרווח הבין קרומי של המיטוכונדריה. מעבר זה הינו אקטיבי וכנגד מפל הריכוזים. הצטברות יוני המימן במרווח הבין קרומי מאפשרת את כניסתם הפסיבית ליצירת מולקולת ATP.]] | ||
<br> | <br> | ||
| + | <p dir='rtl'> | ||
להלן שלושה סרטונים: | להלן שלושה סרטונים: | ||
<br> | <br> | ||
| Line 23: | Line 26: | ||
==<div style="text-align: right;">מבנה המולקולה </div> == | ==<div style="text-align: right;">מבנה המולקולה </div> == | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | ציטוכרום C משתייך למשפחת חלבונים בשם all-α proteins, המאופיינים בליבה העשויה <scene name='89/898985/Secondary_structure/ | + | ציטוכרום C משתייך למשפחת חלבונים בשם all-α proteins, המאופיינים בליבה העשויה <scene name='89/898985/Secondary_structure/4'>מהמבנה השניוני</scene> |
| + | |||
| + | אלפא הליקס (מקרא צבעים לסצנה מבנה שניוני: {{Template:ColorKey_Helix}}) | ||
| + | .כל חלבון במשפחת-על זו מכיל גם קבוצת הם אחת או יותר. | ||
<br> | <br> | ||
| - | + | <scene name='89/898985/Hem_c/2'>HEME C</scene> - קבוצת ההם הינה תרכובת אורגנית המיוצרת במח העצם ובכבד, קבוצה פרוסתטית - תרכובת קטנה המהווה חלק מחלבון. פעולותיה הפיזיולוגיות של קבוצת ההם נובעות מיכולתו של אטום הברזל לקשור מולקולות קטנות (מולקולה דו-אטומית של חמצן, למשל), וכן לחזר ולחמצן תרכובות אחרות (לתרום אלקטרונים ולקבל אלקטרונים, בהתאמה) . | |
| - | + | ||
<br> | <br> | ||
| - | + | ציטוכרום C אנושי <scene name='89/898985/Amino_acids/4'>בנוי מרצף של 104 חומצות אמינו</scene>.שתי חומצות אמינו קושרות את אטום הברזל <scene name='89/898985/Bond_to_iron_18_80/2'>(היסטדין בעמדה 18 ומתיונין בעמדה 80)</scene> | |
| + | ,שתי חומצות אמינו נקשרות קוולנטית באמצעות אטום גופרית (S) לקבוצת ההם <scene name='89/898985/Bond_to_iron_14_17/2'>(ציסטאין בעמדה 17 וציסטאין בעמדה 14)</scene>. | ||
<br> | <br> | ||
| + | נמצא שיש מוטיב של מספר חומצות אמינו השמור מבחינה אבולוציונית. הכולל בתוכו את חומצות האמינו החשובות לקישור אטום הברזל וקבוצת ההם. <scene name='89/898985/Cxxch_motive/6'>CXXCH</scene> (ציסטאין,X,X,ציסטאין,היסטדין) כאשר X יכולה להיות כל חומצה אמינית שהיא איננה ציסטאין. ניתן לראות שגם בחלבון ציטוכרום C באדם ישנה את אותה התבנית. | ||
<br> | <br> | ||
| - | [[Image:Consurf key small.gif|300px|]] | + | <br> |
| + | תמונה 2 | ||
| + | [[Image:Consurf key small.gif|center|300px|מקרא צבעים לייצוג שמירות אבולוציונית - | ||
| + | סגול כהה מייצג חומצות אמינו השמורות באבולוציה וזהות באורגניזמים שונים, | ||
| + | לבן מייצג חומצות אמינו עם שמירות ממוצעת | ||
| + | כחול מייצג חומצות אמינו שאינן שמורות אבולוציונית ועמדות אלו מאופיינות במגוון של חומצות אמינו משתנות בין אורגניזמים שונים. | ||
| + | |||
| + | ]] | ||
<br> | <br> | ||
<br> | <br> | ||
| - | HEME C - קבוצת ההם הינה תרכובת אורגנית המיוצרת במח העצם ובכבד, קבוצה פרוסתטית - תרכובת קטנה המהווה חלק מחלבון. פעולותיה הפיזיולוגיות של קבוצת ההם נובעות מיכולתו של אטום הברזל לקשור מולקולות קטנות (מולקולה דו-אטומית של חמצן, למשל), וכן לחזר ולחמצן (לתרום אלקטרונים ולקבל אלקטרונים, בהתאמה) תרכובות אחרות. | ||
</p> | </p> | ||
==<div style="text-align: right;">תפקוד </div> == | ==<div style="text-align: right;">תפקוד </div> == | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | בשרשרת הולכת האלקטרונים ציטוכרום C מעביר אלקטרון בין קומפלקסי הנשימה III ו-IV; קומפלקס III נקרא ציטוכרום bc1 וקומפלקס-IV נקרא ציטוכרום C אוקסידאז. מעבר האלקטרונים מתאפשר עקב מצב חמצון משתנה של אטום הברזל. בתחילה, יון הברזל בקבוצת ההם בציטוכרום C נמצא במצב מופחת, Fe3+; זה מאפשר קליטה של אלקטרון אחד | + | בשרשרת הולכת האלקטרונים ציטוכרום C מעביר אלקטרון בין קומפלקסי הנשימה III ו-IV; קומפלקס III נקרא ציטוכרום bc1 וקומפלקס-IV נקרא ציטוכרום C אוקסידאז. מעבר האלקטרונים מתאפשר עקב מצב חמצון משתנה של אטום הברזל. בתחילה, יון הברזל בקבוצת ההם בציטוכרום C נמצא במצב מופחת, Fe3+; זה מאפשר קליטה של אלקטרון אחד ומחזר את הברזל למצב Fe2+. |
<br> | <br> | ||
<br> | <br> | ||
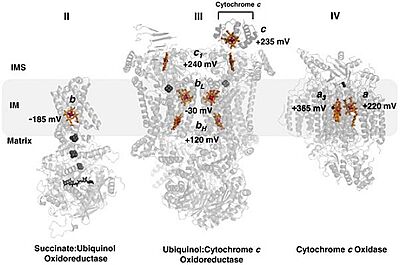
| - | [[Image:Cytochrome C Oxydoreductase.jpg|border|400px|]] | + | תמונה 3 |
| + | </p> | ||
| + | [[Image:Cytochrome C Oxydoreductase.jpg|border|center|400px|בתמונה ניתן לראות את הקומפלקסים השונים בתהליך שרשרת הולכת האלקטרונים - ציטוכרום סי הינו חלבון קטן ביחס לקומפלקסים 2,3 ו- 4 ואיננו טראנסממברנלי. החלבון נע על גבי הממברנה הפנימית של המיטוכונדריה בין קומפלקס 3 לקומפלקס 4. ניתן לראות שלכל חלבוני הולכת האלקטרונים קשורות קבוצות הם.]] | ||
<br> | <br> | ||
<br> | <br> | ||
| - | לציטוכרום C תפקיד נוסף וחשוב בתהליך מוות מבוקר של התא ( | + | <p dir='rtl'> |
| + | לציטוכרום C תפקיד נוסף וחשוב בתהליך מוות מבוקר של התא (תהליך המכונה [https://he.wikipedia.org/wiki/%D7%90%D7%A4%D7%95%D7%A4%D7%98%D7%95%D7%96%D7%94 אפופטוזיס] ). תהליך זה מאפשר התפתחות איברים תקינה בשלב ההתפתחות העוברית, אחראי לסלקציה של תאי דם לבנים, להרג תאים סרטניים או חולים ולהרג של תאים זקנים. | ||
<br> | <br> | ||
<br> | <br> | ||
| Line 51: | Line 67: | ||
כאשר ציטוכרום C מתפקד כנשא אלקטרונים הוא מעוגן לממברנה הפנימית של המיטוכונדריה באמצעות קשר הידרופובי לפוסופליפיד קרדיוליפין (מולקולה הידרופובית הבונה את הממברנה של המיטוכונדריה). | כאשר ציטוכרום C מתפקד כנשא אלקטרונים הוא מעוגן לממברנה הפנימית של המיטוכונדריה באמצעות קשר הידרופובי לפוסופליפיד קרדיוליפין (מולקולה הידרופובית הבונה את הממברנה של המיטוכונדריה). | ||
<br> | <br> | ||
| - | <br> | + | <br> |
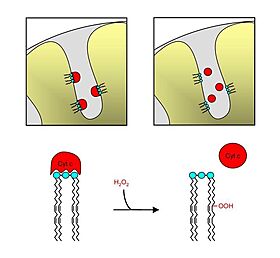
| - | [[Image: | + | תמונה 4 |
| + | </p> | ||
| + | [[Image:Cardiolipin.jpg|border|center|280px|באיור בצד שמאל ניתן לראות את החלבון ציטוכרום סי (אדום) מחובר לפוספוליפיד קרדיוליפין ומעוגן בממברנה הפנימית של המיטוכונדריה. באיור בצד ימין ניתן לראות את הפירוק של הקומפלקס קרדיוליפין + ציטוכרום סי כתוצאה מחימצון מולקולת קרדיוליפין. ציטוכרום סי מתנתק מהממברנה וחופשי לצאת לציטוזול.]] | ||
<br> | <br> | ||
<br> | <br> | ||
| - | תחילת תהליך המוות התאי מאופיינת בעלייה של רדיקלים חופשיים (ROS) במיטוכונדריה. כתוצאה מכך, קרדיוליפין מתחמצן והקומפלקס קרדיוליפין-ציטוכרום C נפרד. ציטוכרום C מנותק מהממברנה הפנימית של המיטוכונדריה ועובר דרך נקבוביות בממברנה החיצונית אל הציטופלזמה. בציטופלזמה ציטוכרום C נקשר לחלבון APAF1 וביחד עם dATP נוצר מכלול הקושר ומבקע את החלבון פרוקספאז 9 לצורתו הבוגרת והפעילה. בכך מתאפשר חיבור עם קספאזות 3 ו- 7 | + | <p dir='rtl'> |
| + | תחילת תהליך המוות התאי מאופיינת בעלייה של רדיקלים חופשיים (ROS) במיטוכונדריה. כתוצאה מכך, קרדיוליפין מתחמצן והקומפלקס קרדיוליפין-ציטוכרום C נפרד. ציטוכרום C מנותק מהממברנה הפנימית של המיטוכונדריה ועובר דרך נקבוביות בממברנה החיצונית אל הציטופלזמה. בציטופלזמה ציטוכרום C נקשר לחלבון APAF1 וביחד עם dATP נוצר מכלול- מבנה האפופטוזום, הקושר ומבקע את החלבון פרוקספאז 9 לצורתו הבוגרת והפעילה. בכך מתאפשר חיבור עם קספאזות 3 ו- 7 והפעלתן. פעילות זו מובילה לפגיעה וקיטוע ה DNA המסתיים במוות מכוון של התא. | ||
<br> | <br> | ||
<br> | <br> | ||
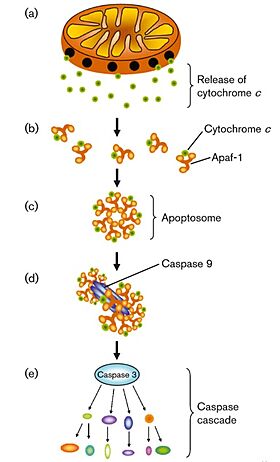
| - | [[Image:Apoptosome.jpg|border|280px|]] | + | תמונה 5 |
| + | </p> | ||
| + | [[Image:Apoptosome.jpg|border|center|280px|באיור מתוארת תחילה ההשתחררות של ציטוכרום סי מהמיטוכונדריה אל הציטוזול. לאחר מכן ציטוכרום סי נקשר לחלבון ציטופלזמי היוצר את מכלול האפופטוזום, מכלול זה מהווה את אחד ממרכזי הבקרה החשובים ביותר של האפופטוזה - הוא קושר ומבקע את החלבון פרוקספאז 9, משחרר אותו בצורתו הבוגרת והפעילה, וכך מפעיל את המסלול האפופטוטי הפנימי המסתיים במוות מכוון של התא.]] | ||
<br> | <br> | ||
<br> | <br> | ||
| + | <p dir='rtl'> | ||
מניעת אפופטוזיס - | מניעת אפופטוזיס - | ||
<br> | <br> | ||
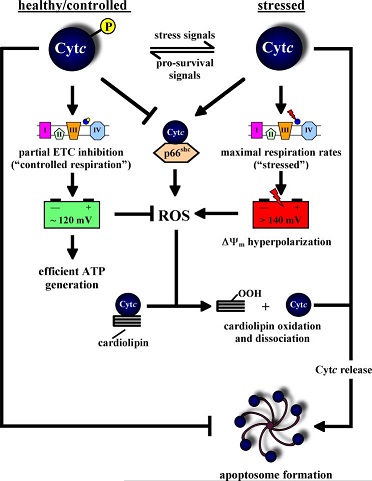
| - | מחקרים מראים שתאים יכולים לשלוט ולבקר על תהליך האפופטוזיס באמצעות | + | מחקרים מראים שתאים יכולים לשלוט ולבקר על תהליך האפופטוזיס באמצעות מודיפיקציה לאחר תרגום בחלבון. חלבונים, כידוע, הם שרשרות ארוכות של חומצות אמיניות. השלב הראשון בבניית החלבון הוא סינתזת שרשרת החומצות האמיניות; אך על פי רוב, המבנה הראשוני הזה עובר שלבים נוספים של עיבוד, הנקראים מודיפיקציות (התאמות). אחד מסוגי המודיפיקציות הוא זרחון. תהליך הזרחון הינו הוספה של קבוצת זרחה (יון המכיל אטום זרחן אחד וארבעה אטומי חמצן). אנזימי קינאז מוסיפים קבוצות זרחה ואנזימי פוספטאז מסירים אותן. סימון מולקולות באמצעות זרחון משמש לבקרה על מגוון עצום של תהליכים בתאים חיים .בציטוכרום C התגלו מספר חומצות אמינו שמורות מאוד מבחינה אבולוציונית <scene name='89/898985/Phosphotyrosine_48_97/4'>העוברות זרחון</scene> (פוספורלציה) ובכך מקנות לחלבון פעילות מבוקרת המונעת יצירה מוגברת של רדיקלים חופשיים (ROS). |
<br> | <br> | ||
<br> | <br> | ||
| - | [[Image:Apoptosome formation.jpg|border|]] | + | תמונה 6 |
| + | </p> | ||
| + | [[Image:Apoptosome formation.jpg|border|center|בתרשים מוצגת פעילות החלבון במצב מזורחן (מבוקר) ובמצב לא מזורחן (לא מבוקר); במצב מבוקר ניתן לראות שקצב הנשימה מווסת ולכן נוצרים מעט רדיקלים חופשיים, פוטנציאל הממברנה חיובי וציטוכרום סי קשור לממברנה הפנימית של המיטוכונדריה באמצעות קרדיוליפין. | ||
| + | במצב לא מבוקר קצב הנשימה התאית הינו קצב מקסימאלי המייצר פוטנציאל ממברנה שלילי, יש עלייה בייצור רדיקלים חופשיים וקומפלקס קרדיוליפין+ציטוכרום סי נפרד. | ||
| + | ]] | ||
<br> | <br> | ||
<br> | <br> | ||
| - | [[Image:Cytochrome c alignment.jpg|border|]] | + | <p dir='rtl'> |
| + | תמונה 7 | ||
| + | </p> | ||
| + | [[Image:Cytochrome c alignment.jpg|border|center|עימוד ציטוכרום סי מאדם ומעכבר (מרקמה סומטית ומרקמת תאי מין) מאפשר לזהות עמדות שמורות אבולוציונית. ניתן לראות את עמדות 14 ו- 17 הקושרות קוולנטית את קבוצת ההם (חומצות אמינו ציסטאין המסומנות באות הגדולה סי). במיקום החיצים נמצאות עמדות שמורות העוברות מודיפיקציות לאחר תרגום, ביניהן גם עמדות 48 ו- 97 (חומצה אמינית טירוזין המסומנת באות וואי) המוזכרות בערך זה. ]] | ||
<br> | <br> | ||
<br> | <br> | ||
| + | <p dir='rtl'> | ||
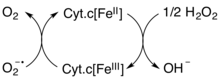
פעילותו כנוגד חמצון (מפחית ROS) נעשית גם באופן ישיר על ידי הסרת סופראוקסיד (O2–) ומי חמצן (H2O2) מהמיטוכונדריה לפי התרשים הבא- | פעילותו כנוגד חמצון (מפחית ROS) נעשית גם באופן ישיר על ידי הסרת סופראוקסיד (O2–) ומי חמצן (H2O2) מהמיטוכונדריה לפי התרשים הבא- | ||
<br> | <br> | ||
<br> | <br> | ||
| - | [[Image:Antioxidante.png]] | + | תמונה 8 |
| + | </p> | ||
| + | [[Image:Antioxidante.png|center|]] | ||
<br> | <br> | ||
<br> | <br> | ||
| + | <p dir='rtl'> | ||
ציטוכרום C הינו חלבון המשחק תפקיד מרכזי בתהליכי יצור האנרגיה בתא וכמו גם שחקן מפתח בתהליכים של מוות תאי מבוקר. | ציטוכרום C הינו חלבון המשחק תפקיד מרכזי בתהליכי יצור האנרגיה בתא וכמו גם שחקן מפתח בתהליכים של מוות תאי מבוקר. | ||
</p> | </p> | ||
==<div style="text-align: right;">גנטיקה </div> == | ==<div style="text-align: right;">גנטיקה </div> == | ||
<p dir='rtl'> | <p dir='rtl'> | ||
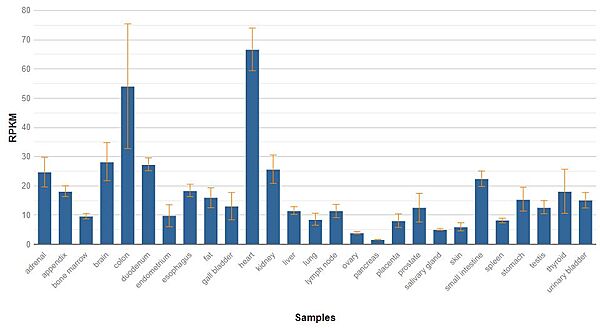
| - | הגן CYCS | + | הגן CYCS המקודד לחלבון ציטוכרום C באדם נמצא בכרומוזום 7 ב DNA בגרעין התא . זאת בשונה מחלבונים אחרים המתפקדים באברון המיטוכונדריה המקודדים מ DNA מיטוכונדריאלי. ביחס ל-DNA הגרעיני, ה-DNA המיטוכונדריאלי הוא זעיר ממש, מורכב מכרומוזום אחד קטן וכולל פחות מ-17 אלף זוגות בסיסים, בהשוואה לכשלושה מיליארד הבסיסים ב-23 זוגות הכרומוזומים בגרעין. עם זאת, בכל תא יש רק גרעין אחד ומיטוכונדריה רבים: בחלק מהתאים מספר אברוני מיטוכונדריה מגיע לאלפים, ולכן יש בהם גם אלפי עותקים של ה-DNA המיטוכונדריאלי. הבדל נוסף בין סוגי ה-DNA הוא שאת ה-DNA המיטוכונדריאלי אנחנו מקבלים מהאם בלבד. בתא הזרע יש מיטוכונדריה, אך הם נמצאים ב"זנב" של התא, שנשאר בחוץ כאשר הוא מתאחד עם הביצית. ה-DNA המיטוכונדריאלי מקודד ל-13 חלבונים החיוניים לתפקוד המיטוכונדריה כ"תחנת הכוח של התא". |
<br> | <br> | ||
בגנום האנושי נמצאו 49 פסאודוגנים לגן CYCS (גנים שאינם עוברים שעתוק ותרגום לחלבונים) . לגן שלושה אקסונים . | בגנום האנושי נמצאו 49 פסאודוגנים לגן CYCS (גנים שאינם עוברים שעתוק ותרגום לחלבונים) . לגן שלושה אקסונים . | ||
| Line 90: | Line 123: | ||
<br> | <br> | ||
<br> | <br> | ||
| - | [[Image:Expression cytochrome c.JPG|border|600px|]] | + | תמונה 9 |
| + | [[Image:Expression cytochrome c.JPG|border|center|600px|]] | ||
</p> | </p> | ||
<br> | <br> | ||
==<div style="text-align: right;">מחלות </div> == | ==<div style="text-align: right;">מחלות </div> == | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | מוטציה בגן CYCS <scene name='89/898985/Gly__41/3'> | + | מוטציה בגן CYCS המאופיינת בחילוף חומצה אמינית <scene name='89/898985/Gly__41/3'>גליצין בעמדה 41(עמדה שמורה) </scene> לחומצה אמינית סרין נמצאה אצל אנשים הלוקים בתסמונת טרומבוציטופניה אוטוזומלית דומיננטית - הפרעה המטולוגית המוגדרת על ידי ירידה במספר הטסיות בדם במחזור הדם, וכתוצאה מכך פוטנציאל לדימום מוגבר וירידה ביכולת הקרישה. נבחן הקשר בין איפיון זה להתפתחות המחלה. במחקרים שנערכו לאחרונה נמצא שמוטציה זו מגבירה את הפעילות הפרו-אפופטוטית על ידי הפעלת קספזה בצורה יעילה יותר מאשר החלבון התקין. מוטציה זו איננה משפיעה על פונקציית החיזור של החלבון. |
</p> | </p> | ||
==<div style="text-align: right;">דף עבודה לתלמיד </div> == | ==<div style="text-align: right;">דף עבודה לתלמיד </div> == | ||
| + | <p dir='rtl'> | ||
| + | [https://proteopedia.org/wiki/images/d/d8/%D7%93%D7%A3_%D7%A2%D7%91%D7%95%D7%93%D7%94_%D7%9C%D7%AA%D7%9C%D7%9E%D7%99%D7%93_-_cytochrome_C.pdf דף עבודה לתלמיד] | ||
| + | <br> | ||
| + | [https://proteopedia.org/wiki/images/0/08/%D7%A0%D7%A1%D7%A4%D7%97_FASTA_%D7%A9%D7%9C_%D7%94%D7%97%D7%9C%D7%91%D7%95%D7%A0%D7%99%D7%9D.doc נספח] | ||
| + | </p> | ||
<br> | <br> | ||
==<div style="text-align: right;">מקורות מידע </div> == | ==<div style="text-align: right;">מקורות מידע </div> == | ||
<br> | <br> | ||
| + | [https://pubchem.ncbi.nlm.nih.gov/compound/444125#section=3D-Conformer pubchem] | ||
| + | <br> | ||
| + | [https://www.ncbi.nlm.nih.gov/protein/NP_061820.1 ncbi - cytochrome c - homo sapiens] | ||
| + | <br> | ||
| + | [https://ashpublications.org/blood/article/132/Supplement%201/3758/265249/A-Novel-Cycs-Missense-Mutation-in-the-Helix-of-the A Novel Cycs Missense Mutation in the α-Helix of the Cycs C-Terminal Domain Causes Non-Syndromic Thrombocytopenia] | ||
| + | <br> | ||
| + | [https://davidson.weizmann.ac.il/online/sciencenews/%D7%9C%D7%A8%D7%90%D7%95%D7%AA-%D7%90%D7%AA-%D7%94%D7%9E%D7%95%D7%9C%D7%A7%D7%95%D7%9C%D7%95%D7%AA-%D7%A0%D7%98%D7%A2%D7%A0%D7%95%D7%AA לראות את המולקולות נטענות - מכון דוידסון] | ||
| + | <br> | ||
| + | [https://www.ncbi.nlm.nih.gov/genome/gdv/browser/gene/?id=54205 ncbi cics gene] | ||
| + | <br> | ||
| + | [https://www.rcsb.org/structure/1gu2 pdb - 1GU2] | ||
| + | <br> | ||
| + | [https://www.rcsb.org/structure/1AKK pdb - 1AKK] | ||
| + | <br> | ||
| + | [https://chem.libretexts.org/Courses/Saint_Marys_College_Notre_Dame_IN/CHEM_342%3A_Bio-inorganic_Chemistry/Readings/Metals_in_Biological_Systems_(Saint_Mary's_College)/Cytochrome_C Cytochrome C. (2019, June 5).] | ||
| + | <br> | ||
| + | [https://www.ncbi.nlm.nih.gov/gene/54205 ncbi - CYCS cytochrome c - Homo sapiens] | ||
| + | <br> | ||
| + | [https://www.nature.com/articles/nrm2434 nature - Cytochrome c: functions beyond respiration] | ||
Current revision
אנושי C ציטוכרום
ציטוכרום C הוא חלבון קטן (משקלו המולקולרי כ-12,000 דלטון) שמור מאוד לאורך האבולוציה ומצוי בצמחים, בבעלי חיים ובאורגניזמים חד-תאיים רבים. לחלבון קשורה קבוצת הם ובמרכזה אטום ברזל. חלבון מפתח בשרשרת הולכת האלקטרונים ובתהליך האפופטוזיס (מוות מבוקר של התא).
| |||||||||||
Proteopedia Page Contributors and Editors (what is this?)
Rachel Krucker, Nitzan Hodorov Keinan, Fatima M Hameed, Michal Harel