Beta-galactosidase (hebrew)
From Proteopedia
(Difference between revisions)
| (24 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
==<center>'''בטא-גלקטוזידאז'''</center>== | ==<center>'''בטא-גלקטוזידאז'''</center>== | ||
| - | <StructureSection load=' | + | <StructureSection load='1dp0' size='340' side='left' caption='Caption for this structure scene ='89/898980/Protein/1'> |
<p dir='rtl'> | <p dir='rtl'> | ||
</p> | </p> | ||
| Line 7: | Line 7: | ||
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
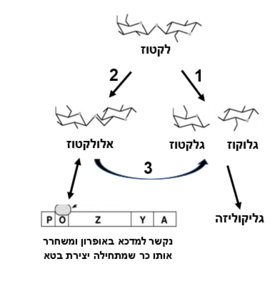
| - | בטא-גלקטוזידאז הוא אנזים הקיים בחיידקי E.coli, ובאורגניזמים רבים אחרים, האחראי על פירוק לקטוז (דו סוכר המורכב מגלוקוז ופרוקטוז). | + | בטא-גלקטוזידאז הוא אנזים הקיים בחיידקי ''E.coli'', ובאורגניזמים רבים אחרים, האחראי על פירוק לקטוז (דו סוכר המורכב מגלוקוז ופרוקטוז). |
<br> | <br> | ||
חד סוכרים אלו מהווים מקורות אנרגיה לחיידק (החיידק מפרק אותם בתהליך | חד סוכרים אלו מהווים מקורות אנרגיה לחיידק (החיידק מפרק אותם בתהליך | ||
| Line 13: | Line 13: | ||
[https://www.jove.com/embed/player?id=10737&access=j9gou5mhsf&t=1&s=1&fpv=1 גליקוליזה)]. | [https://www.jove.com/embed/player?id=10737&access=j9gou5mhsf&t=1&s=1&fpv=1 גליקוליזה)]. | ||
<br> | <br> | ||
| - | בחיידקי E.coli, האנזים הוא תוצר של הגן lacZ | + | בחיידקי ''E.coli'', האנזים הוא תוצר של הגן lacZ |
שהינו חלק | שהינו חלק | ||
[https://www.britannica.com/science/operon מאופרון] | [https://www.britannica.com/science/operon מאופרון] | ||
| Line 26: | Line 26: | ||
- הידרוליזה של אלולקטוז לגלקטוז+גלוקוז | - הידרוליזה של אלולקטוז לגלקטוז+גלוקוז | ||
<br> | <br> | ||
| - | לתוצר אלולקטוז יש תפקיד בבקרה הגנטית על בטאגלקטוזידאז (ראה פסקה על אופרון הלקטוז) | + | לתוצר אלולקטוז יש תפקיד בבקרה הגנטית על בטאגלקטוזידאז (ראה פסקה על אופרון הלקטוז) <ref> Douglas H.Juers, Raymond H.Jacobson, Dale Wigley, Xue-Jun Zhang, Reuben E.Huber, Dale E.Tronrud and Brian W.Matthews (2000) , ''High resolution refinement of b-galactosidase in a new crystal form reveals multiple metal-binding sites and provides a structural basis for a-complementation'', Protein Science 9:1685–1699. Cambridge University Press. Printed in the USA |
| + | https://pubmed.ncbi.nlm.nih.gov/11045615/ </ref> <ref name="Douglas h. juers"> Douglas H. Juers, Brian W. Matthews, and Reuben E. Huber, | ||
| + | ''LacZ b-galactosidase: Structure and function of an enzyme of historical and molecular biological importance'', Protein Sci 2012 Dec;21(12):1792-807. doi: 10.1002/pro.2165. Epub 2012 Nov 13. | ||
| + | https://pubmed.ncbi.nlm.nih.gov/23011886/ </ref> | ||
</p> | </p> | ||
<br> | <br> | ||
| Line 33: | Line 36: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
הגן המקודד לאנזים בטא-גלקטוזידאז נמצא גם בגנום של בני אדם (הרבה פעמים האנזים המקודד על ידי גן זה מכונה: לקטאז). | הגן המקודד לאנזים בטא-גלקטוזידאז נמצא גם בגנום של בני אדם (הרבה פעמים האנזים המקודד על ידי גן זה מכונה: לקטאז). | ||
| + | גן זה מתבטא בעיקר בתקופת הינקות. | ||
<br> | <br> | ||
| - | + | אצל רוב בני האדם (כ-70%) פעילות האנזים הולכת ופוחתת לאחר תקופה זו כיוון שרמת הביטוי שלו יורדת, | |
| + | דבר הגורם להרבה אנשים לבטא אי סבילות ללקטוז (כיוון שהלקטוז לא מתפרק). | ||
<br> | <br> | ||
| - | + | בנוסף, בקרב אחוז קטן של אנשים באוכלוסייה, ישנה אי סבילות ללקטוז הנובעת מחסר מולד באנזים (מוטציה בגן לבטא-גלקטוזידאז). | |
<br> | <br> | ||
חברות מזון שונות מוסיפות את האנזים, המופק מאורגנזימים שונים, למזונות המכילים לקטוז כדי שהאנזים יפרק את הלקטוז | חברות מזון שונות מוסיפות את האנזים, המופק מאורגנזימים שונים, למזונות המכילים לקטוז כדי שהאנזים יפרק את הלקטוז | ||
וכך גם אנשים בעלי אי סבילות ללקטוז יכולים להנות ממזונות אלה. | וכך גם אנשים בעלי אי סבילות ללקטוז יכולים להנות ממזונות אלה. | ||
<br> | <br> | ||
| - | לאחרונה נחקר האנזים כטיפול אפשרי לאי-סבילות ללקטוז על ידי ריפוי גני, בהחדרת הגן לאנזים זה ל-DNA, על מנת שאנשים החסרים לקטאז יוכלו לבקע לקטוז בדרך זו. | + | לאחרונה נחקר האנזים כטיפול אפשרי לאי-סבילות ללקטוז הנובעת מחסר באנזים, על ידי [https://he.wikipedia.org/wiki/%D7%A8%D7%99%D7%A4%D7%95%D7%99_%D7%92%D7%A0%D7%99 ריפוי גני] , בהחדרת הגן לאנזים זה ל-DNA, על מנת שאנשים החסרים לקטאז יוכלו לבקע לקטוז בדרך זו.<ref> בטא-גלקטוזידאז באתר ויקירפואה:[https://www.wikirefua.org.il/w/index.php/%D7%91%D7%98%D7%90-%D7%92%D7%9C%D7%A7%D7%98%D7%95%D7%96%D7%99%D7%93%D7%90%D7%96_-_Beta-galactosidase#.D7.AA.D7.A8.D7.97.D7.99.D7.A9.D7.99.D7.9D_.D7.A7.D7.9C.D7.99.D7.A0.D7.99.D7.99.D7.9D_.D7.91.D7.97.D7.A1.D7.A8_.D7.94.D7.90.D7.A0.D7.96.D7.99.D7.9D]</ref> |
</p> | </p> | ||
| Line 47: | Line 52: | ||
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
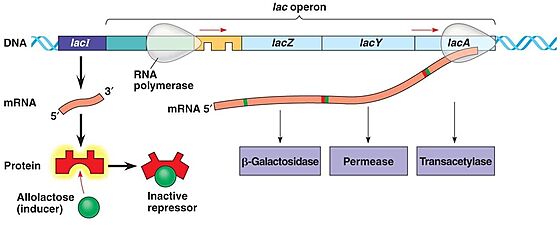
| - | מאחר ולקטוז הוא לא מקור האנרגיה המועדף על החיידק E.coli הוא לא מנצל אותו כמקור אנרגיה בתנאים בהם קיימים בסביבתו מקורות אנרגיה עדיפים | + | מאחר ולקטוז הוא לא מקור האנרגיה המועדף על החיידק ''E.coli'' הוא לא מנצל אותו כמקור אנרגיה בתנאים בהם קיימים בסביבתו מקורות אנרגיה עדיפים. היות ותהליך יצירת החלבונים הוא תהליך צורך אנרגיה, על החיידק לבטא את החלבונים המפרקים לקטוז רק כאשר הלקטוז משמש כמקור ההזנה שלו. בהיעדר לקטוז, תופעל בקרה גנטית אשר תמנע ייצור מיותר של האנזים. |
<br> | <br> | ||
מבנה אופרון הלקטוז: | מבנה אופרון הלקטוז: | ||
| Line 74: | Line 79: | ||
'''בקרה שלילית באופרון הלקטוז-''' | '''בקרה שלילית באופרון הלקטוז-''' | ||
<br> | <br> | ||
| - | כאשר חלבון הרפרסור נקשר לאתר האופרטור, הוא מונע את קשירתו של האנזים RNA polymerase לאתר הפרומוטור וכך נמנע תעתוק האופרון. | + | כאשר חלבון הרפרסור נקשר לאתר האופרטור, הוא מונע את קשירתו של האנזים RNA polymerase לאתר הפרומוטור וכך נמנע תעתוק האופרון. כאשר מגדלים את החיידק על מצע לקטוז, הלקטוז מפורק על-ידי מעט האנזימים המתבטאים ברמה נמוכה ונוצר אלולקטוז. |
| - | + | אלולקטוז נקשר לחלבון הרפרסור, משנה את מבנהו המרחבי ומסיר אותו מהאופרטור. זה מאפשר את קשירת RNA polymerase לפרומוטור ומתבצע תעתוק של האופרון. | |
| - | (ראה איור 2) | + | (ראה איור 2) <ref> אופרון הלקטוז באתר דוידסון אונליין: [https://davidson.weizmann.ac.il/online/tikshuv/life_sci/%D7%91%D7%A7%D7%A8%D7%94-%D7%92%D7%A0%D7%98%D7%99%D7%AA-%D7%90%D7%95%D7%A4%D7%A8%D7%95%D7%9F-%D7%94%D7%9C%D7%A7%D7%98%D7%95%D7%96] </ref> <ref> יהודית עתידיה (2001), ''גנטיקה'', האוניברסיטה העברית, משרד החינוך ומטה מל"מ. 171-174</ref> |
</p> | </p> | ||
<br> | <br> | ||
| Line 84: | Line 89: | ||
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | החלבון בטא-גלאקטוזידאז מהאורגניזם E.coli הינו | + | החלבון בטא-גלאקטוזידאז מהאורגניזם ''E.coli'' הינו הומוטטרמר שמורכב מ<scene name='89/898980/Four_monomer_of_the_protein/2'>ארבעה מונומרים זהים</scene>,כל מונומר מורכב מ- 1023 <scene name='89/898980/Amino_acid/1'>חומצות אמיניות.</scene> |
| + | בסצנת החומצות האמיניות ניתן לראות כי כל חומצה אמינית צבועה בצבע שונה. | ||
<br> | <br> | ||
| - | ישנם ארבעה אתרים פעילים, <scene name='89/898980/Active_site1/1'>אתר פעיל</scene> בכל מונומר. | + | ישנם ארבעה אתרים פעילים, <scene name='89/898980/Active_site1/1'>אתר פעיל אחד</scene> בכל מונומר.כאשר האנזים פעיל, יכולות להיקשר אליו ארבע מולוקולת של לקטוז, אחת בכל אתר פעיל. |
<br> | <br> | ||
האתרים הפעילים פועלים באופן עצמאי, אך פעילותם תלויה במבנה התקין של הטטרמר. | האתרים הפעילים פועלים באופן עצמאי, אך פעילותם תלויה במבנה התקין של הטטרמר. | ||
| Line 97: | Line 103: | ||
ישנם מספר <scene name='89/898980/Mg_and_na/1'>יוני נתרן ומגנזיום</scene> הקשורים לחומצות אמיניות שונות בחלבון. תפקידם ככל הנראה לאפשר ייצוב של המבנה המרחבי של כל אחד משני הדימרים המרכיבים את הטטרמר, | ישנם מספר <scene name='89/898980/Mg_and_na/1'>יוני נתרן ומגנזיום</scene> הקשורים לחומצות אמיניות שונות בחלבון. תפקידם ככל הנראה לאפשר ייצוב של המבנה המרחבי של כל אחד משני הדימרים המרכיבים את הטטרמר, | ||
<br> | <br> | ||
| - | ביניהם <scene name='89/898980/Active_site_mg/1'>יון מגנזיום הקשור באתר הפעיל</scene> מאפשר פעילות מיטבית של האנזים. | + | ביניהם <scene name='89/898980/Active_site_mg/1'>יון מגנזיום הקשור באתר הפעיל</scene> (צבוע בצבע אדום )מאפשר פעילות מיטבית של האנזים. <ref name="Douglas h. juers"/> <ref name="NCBI"> https://www.ncbi.nlm.nih.gov/protein/P00722.2 חלבון בטא-גלקטוזידאז - NCBI </ref> |
| + | <br> | ||
</p> | </p> | ||
| Line 111: | Line 118: | ||
עם זאת, בחלבונים שונים ניתן לראות עמדות ששמורות לאורך האבולוציה, גם בין יצורים רחוקים אבולוציונית זה מזה. | עם זאת, בחלבונים שונים ניתן לראות עמדות ששמורות לאורך האבולוציה, גם בין יצורים רחוקים אבולוציונית זה מזה. | ||
<br> | <br> | ||
| - | העובדה שאותן עמדות שמורות ביצורים שרחוקים אבולוציונית זה מזה, מעידה על חשיבות העמדות אלו לתפקוד החלבון. | + | העובדה שאותן עמדות שמורות ביצורים שרחוקים אבולוציונית זה מזה, מעידה על חשיבות העמדות אלו לתפקוד או קיפול החלבון. |
<br> | <br> | ||
במבנה האנזים בטא-גלקטוזידאז יש מספר אתרים החשובים לתפקודו. | במבנה האנזים בטא-גלקטוזידאז יש מספר אתרים החשובים לתפקודו. | ||
| Line 130: | Line 137: | ||
<br> | <br> | ||
הדוגמא באיור 3 מציגה עימוד של האנזים בטא-גלקטוזידאז בחיידקים שונים, בהשוואה לחיידק | הדוגמא באיור 3 מציגה עימוד של האנזים בטא-גלקטוזידאז בחיידקים שונים, בהשוואה לחיידק | ||
| - | E.coli, אשר נמצא בשורה הראשונה. '''עמדות שמורות המסומנות באדום''' הן עמדות חשובות בתפקוד החלבון. | + | ''E.coli'', אשר נמצא בשורה הראשונה. '''עמדות שמורות המסומנות באדום''' הן עמדות חשובות בתפקוד החלבון. <ref name="NCBI"/> <ref> https://www.rcsb.org/structure/1DP0 מבנה החלבון בטא-גלקטוזידאז - PDB </ref> |
[[Image:Imud.PNG|thumb|center|560px|איור 3: תוצאות עימוד בטא-גלקטוזידאז]] | [[Image:Imud.PNG|thumb|center|560px|איור 3: תוצאות עימוד בטא-גלקטוזידאז]] | ||
</p> | </p> | ||
| Line 147: | Line 154: | ||
'''שימוש כגן מבחין''' | '''שימוש כגן מבחין''' | ||
<br> | <br> | ||
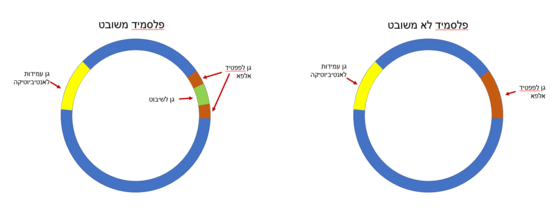
| - | בשיטת מעקב זו הגן לאנזים משמש כגן מבחין המאפשר להבדיל בין | + | בשיטת מעקב זו הגן לאנזים משמש כגן מבחין המאפשר להבדיל בין חיידקים שקלטו |
| - | [https://davidson.weizmann.ac.il/online/maagarmada/technology/%D7%94%D7%A4%D7%9C%D7%A1%D7%9E%D7%99%D7%93-%D7%9B%D7%90%D7%9E%D7%A6%D7%A2%D7%99-%D7%9C%D7%94%D7%A0%D7%93%D7%A1%D7%94-%D7%92%D7%A0%D7%98%D7%99%D7%AA | + | [https://davidson.weizmann.ac.il/online/maagarmada/technology/%D7%94%D7%A4%D7%9C%D7%A1%D7%9E%D7%99%D7%93-%D7%9B%D7%90%D7%9E%D7%A6%D7%A2%D7%99-%D7%9C%D7%94%D7%A0%D7%93%D7%A1%D7%94-%D7%92%D7%A0%D7%98%D7%99%D7%AA פלסמיד] |
| - | שקלטו | + | משובט, לבין חיידקים שקלטו פלמיד שאינו משובט. |
<br> | <br> | ||
השיטה: מכינים חיידקים ללא עמידות לאנטיביוטיקה שהגנום שלהם מכיל גן מוטנטי, המקודד לפפטיד אומגה בלבד (שאינו פעיל ללא פפטיד אלפא). | השיטה: מכינים חיידקים ללא עמידות לאנטיביוטיקה שהגנום שלהם מכיל גן מוטנטי, המקודד לפפטיד אומגה בלבד (שאינו פעיל ללא פפטיד אלפא). | ||
| Line 164: | Line 171: | ||
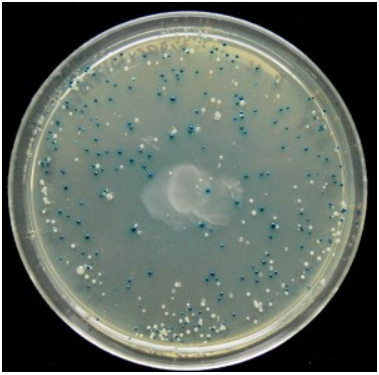
מושבות חיידקים לבנות יעידו על הצלחת השיבוט (משמעות הצבע הלבן היא שלא נוצר פפטיד אלפא ולכן האנזים אינו פעיל ולא נגרם פירוק של ה X-gal במצע). | מושבות חיידקים לבנות יעידו על הצלחת השיבוט (משמעות הצבע הלבן היא שלא נוצר פפטיד אלפא ולכן האנזים אינו פעיל ולא נגרם פירוק של ה X-gal במצע). | ||
<br> | <br> | ||
| - | העובדה שהתפתחו מושבות על גבי המצע, הכולל אנטיביוטיקה, שוללת אפשרות לטעון שמה שנכשל הוא החדרת הפלסמיד כיוון שתכונת העמידות לאנטיביוטיקה הוחדרה באמצעות הפלסמיד. | + | העובדה שהתפתחו מושבות על גבי המצע, הכולל אנטיביוטיקה, שוללת אפשרות לטעון שמה שנכשל הוא החדרת הפלסמיד כיוון שתכונת העמידות לאנטיביוטיקה הוחדרה באמצעות הפלסמיד. <ref name="Douglas h. juers"/> |
</p> | </p> | ||
<br> | <br> | ||
| Line 172: | Line 179: | ||
בשיטה זו בודקים את הבקרה על ביטוי של גנים. | בשיטה זו בודקים את הבקרה על ביטוי של גנים. | ||
<br> | <br> | ||
| - | משבטים את הגן לבטא גלקטוזידאז המלא במורד הזרם מפרומוטור שאת דגם ביטויו רוצים לבדוק.לאחר חשיפה ל X-gal ניתן לראות באילו תנאים או מצבים הגן מתבטא, מה שמעיד על פרומוטור פעיל. | + | משבטים את הגן לבטא גלקטוזידאז המלא במורד הזרם מפרומוטור שאת דגם ביטויו רוצים לבדוק. |
| + | <br> | ||
| + | לאחר חשיפה ל X-gal ניתן לראות באילו תנאים או מצבים הגן מתבטא, מה שמעיד על פרומוטור פעיל. | ||
<br> | <br> | ||
מושבות כחולות יעידו על תאים בהם הפרומוטור פעיל ומושבות לבנות יעידו על פרומוטור מושתק.(ראה איור 5) | מושבות כחולות יעידו על תאים בהם הפרומוטור פעיל ומושבות לבנות יעידו על פרומוטור מושתק.(ראה איור 5) | ||
</p> | </p> | ||
[[Image:X gal.PNG|thumb|center|560px|איור 5: שימוש כגן מדווח, מתוך ויקיפדיה]] | [[Image:X gal.PNG|thumb|center|560px|איור 5: שימוש כגן מדווח, מתוך ויקיפדיה]] | ||
| - | |||
| - | |||
| - | == Structural highlights == | ||
| - | <scene name='89/898980/Four_monomer_of_the_protein/2'>ארבעת המונומרים של החלבון</scene> | ||
| - | <br> | ||
| - | <scene name='89/898980/Alpha_helix_and_beta_sheet/1'>המבנה השניוני של החלבון</scene> | ||
| - | <br> | ||
| - | <scene name='89/898980/Amino_acid/1'>חומצות אמיניות.</scene> | ||
| - | <br> | ||
| - | <scene name='89/898980/Saved_positions_in_evolution/1'>עמדות שמורות לאורך האבולוציה</scene> | ||
| - | <br> | ||
| - | <scene name='89/898980/Alpha_comlementation/1'>פפטיד אלפא</scene> | ||
| - | <br> | ||
| - | <scene name='89/898980/Active_site/1'>עמדות קשירת הסובסטרט</scene> | ||
| - | <br> | ||
| - | <scene name='89/898980/Active_site_plus/1'>האתר הפעיל</scene> | ||
| - | <br> | ||
| - | <scene name='89/898980/Mg_and_na/1'>יוני נתרן ומגנזיום</scene> | ||
| - | <br> | ||
| - | <scene name='89/898980/Active_site_mg/1'>יון מגנזיום הקשור באתר הפעיל</scene> | ||
<br> | <br> | ||
| - | < | + | ==<center>'''דף עבודה לתלמיד'''</center>== |
| - | + | <center>[https://proteopedia.org/wiki/images/8/8c/%D7%93%D7%A3_%D7%A2%D7%91%D7%95%D7%93%D7%94_%D7%91%D7%98%D7%90-%D7%92%D7%9C%D7%A7%D7%98%D7%95%D7%96%D7%99%D7%93%D7%90%D7%96_%D7%9C%D7%AA%D7%9C%D7%9E%D7%99%D7%93.pdf דף עבודה לתלמיד]</center> | |
</StructureSection> | </StructureSection> | ||
| - | == | + | == <center>''' מקורות מידע '''</center> == |
<references/> | <references/> | ||
Current revision
בטא-גלקטוזידאז
| |||||||||||
מקורות מידע
- ↑ Douglas H.Juers, Raymond H.Jacobson, Dale Wigley, Xue-Jun Zhang, Reuben E.Huber, Dale E.Tronrud and Brian W.Matthews (2000) , High resolution refinement of b-galactosidase in a new crystal form reveals multiple metal-binding sites and provides a structural basis for a-complementation, Protein Science 9:1685–1699. Cambridge University Press. Printed in the USA https://pubmed.ncbi.nlm.nih.gov/11045615/
- ↑ 2.0 2.1 2.2 Douglas H. Juers, Brian W. Matthews, and Reuben E. Huber, LacZ b-galactosidase: Structure and function of an enzyme of historical and molecular biological importance, Protein Sci 2012 Dec;21(12):1792-807. doi: 10.1002/pro.2165. Epub 2012 Nov 13. https://pubmed.ncbi.nlm.nih.gov/23011886/
- ↑ בטא-גלקטוזידאז באתר ויקירפואה:[1]
- ↑ אופרון הלקטוז באתר דוידסון אונליין: [2]
- ↑ יהודית עתידיה (2001), גנטיקה, האוניברסיטה העברית, משרד החינוך ומטה מל"מ. 171-174
- ↑ 6.0 6.1 https://www.ncbi.nlm.nih.gov/protein/P00722.2 חלבון בטא-גלקטוזידאז - NCBI
- ↑ https://www.rcsb.org/structure/1DP0 מבנה החלבון בטא-גלקטוזידאז - PDB