Beta-galactosidase (hebrew)
From Proteopedia
(Difference between revisions)
| (13 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
==<center>'''בטא-גלקטוזידאז'''</center>== | ==<center>'''בטא-גלקטוזידאז'''</center>== | ||
| - | <StructureSection load=' | + | <StructureSection load='1dp0' size='340' side='left' caption='Caption for this structure scene ='89/898980/Protein/1'> |
<p dir='rtl'> | <p dir='rtl'> | ||
</p> | </p> | ||
| Line 26: | Line 26: | ||
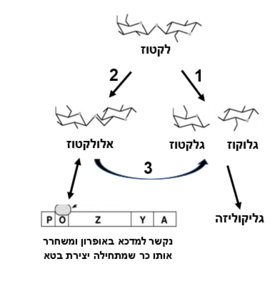
- הידרוליזה של אלולקטוז לגלקטוז+גלוקוז | - הידרוליזה של אלולקטוז לגלקטוז+גלוקוז | ||
<br> | <br> | ||
| - | לתוצר אלולקטוז יש תפקיד בבקרה הגנטית על בטאגלקטוזידאז (ראה פסקה על אופרון הלקטוז) | + | לתוצר אלולקטוז יש תפקיד בבקרה הגנטית על בטאגלקטוזידאז (ראה פסקה על אופרון הלקטוז) <ref> Douglas H.Juers, Raymond H.Jacobson, Dale Wigley, Xue-Jun Zhang, Reuben E.Huber, Dale E.Tronrud and Brian W.Matthews (2000) , ''High resolution refinement of b-galactosidase in a new crystal form reveals multiple metal-binding sites and provides a structural basis for a-complementation'', Protein Science 9:1685–1699. Cambridge University Press. Printed in the USA |
| + | https://pubmed.ncbi.nlm.nih.gov/11045615/ </ref> <ref name="Douglas h. juers"> Douglas H. Juers, Brian W. Matthews, and Reuben E. Huber, | ||
| + | ''LacZ b-galactosidase: Structure and function of an enzyme of historical and molecular biological importance'', Protein Sci 2012 Dec;21(12):1792-807. doi: 10.1002/pro.2165. Epub 2012 Nov 13. | ||
| + | https://pubmed.ncbi.nlm.nih.gov/23011886/ </ref> | ||
</p> | </p> | ||
<br> | <br> | ||
| Line 43: | Line 46: | ||
וכך גם אנשים בעלי אי סבילות ללקטוז יכולים להנות ממזונות אלה. | וכך גם אנשים בעלי אי סבילות ללקטוז יכולים להנות ממזונות אלה. | ||
<br> | <br> | ||
| - | לאחרונה נחקר האנזים כטיפול אפשרי לאי-סבילות ללקטוז הנובעת מחסר באנזים, על ידי [https://he.wikipedia.org/wiki/%D7%A8%D7%99%D7%A4%D7%95%D7%99_%D7%92%D7%A0%D7%99 ריפוי גני] , בהחדרת הגן לאנזים זה ל-DNA, על מנת שאנשים החסרים לקטאז יוכלו לבקע לקטוז בדרך זו. | + | לאחרונה נחקר האנזים כטיפול אפשרי לאי-סבילות ללקטוז הנובעת מחסר באנזים, על ידי [https://he.wikipedia.org/wiki/%D7%A8%D7%99%D7%A4%D7%95%D7%99_%D7%92%D7%A0%D7%99 ריפוי גני] , בהחדרת הגן לאנזים זה ל-DNA, על מנת שאנשים החסרים לקטאז יוכלו לבקע לקטוז בדרך זו.<ref> בטא-גלקטוזידאז באתר ויקירפואה:[https://www.wikirefua.org.il/w/index.php/%D7%91%D7%98%D7%90-%D7%92%D7%9C%D7%A7%D7%98%D7%95%D7%96%D7%99%D7%93%D7%90%D7%96_-_Beta-galactosidase#.D7.AA.D7.A8.D7.97.D7.99.D7.A9.D7.99.D7.9D_.D7.A7.D7.9C.D7.99.D7.A0.D7.99.D7.99.D7.9D_.D7.91.D7.97.D7.A1.D7.A8_.D7.94.D7.90.D7.A0.D7.96.D7.99.D7.9D]</ref> |
</p> | </p> | ||
| Line 76: | Line 79: | ||
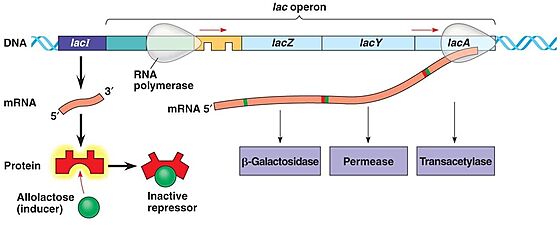
'''בקרה שלילית באופרון הלקטוז-''' | '''בקרה שלילית באופרון הלקטוז-''' | ||
<br> | <br> | ||
| - | כאשר חלבון הרפרסור נקשר לאתר האופרטור, הוא מונע את קשירתו של האנזים RNA polymerase לאתר הפרומוטור וכך נמנע תעתוק האופרון. | + | כאשר חלבון הרפרסור נקשר לאתר האופרטור, הוא מונע את קשירתו של האנזים RNA polymerase לאתר הפרומוטור וכך נמנע תעתוק האופרון. כאשר מגדלים את החיידק על מצע לקטוז, הלקטוז מפורק על-ידי מעט האנזימים המתבטאים ברמה נמוכה ונוצר אלולקטוז. |
| - | + | אלולקטוז נקשר לחלבון הרפרסור, משנה את מבנהו המרחבי ומסיר אותו מהאופרטור. זה מאפשר את קשירת RNA polymerase לפרומוטור ומתבצע תעתוק של האופרון. | |
| - | (ראה איור 2) | + | (ראה איור 2) <ref> אופרון הלקטוז באתר דוידסון אונליין: [https://davidson.weizmann.ac.il/online/tikshuv/life_sci/%D7%91%D7%A7%D7%A8%D7%94-%D7%92%D7%A0%D7%98%D7%99%D7%AA-%D7%90%D7%95%D7%A4%D7%A8%D7%95%D7%9F-%D7%94%D7%9C%D7%A7%D7%98%D7%95%D7%96] </ref> <ref> יהודית עתידיה (2001), ''גנטיקה'', האוניברסיטה העברית, משרד החינוך ומטה מל"מ. 171-174</ref> |
</p> | </p> | ||
<br> | <br> | ||
| Line 89: | Line 92: | ||
בסצנת החומצות האמיניות ניתן לראות כי כל חומצה אמינית צבועה בצבע שונה. | בסצנת החומצות האמיניות ניתן לראות כי כל חומצה אמינית צבועה בצבע שונה. | ||
<br> | <br> | ||
| - | ישנם ארבעה אתרים פעילים, <scene name='89/898980/Active_site1/1'>אתר פעיל אחד</scene> בכל מונומר. | + | ישנם ארבעה אתרים פעילים, <scene name='89/898980/Active_site1/1'>אתר פעיל אחד</scene> בכל מונומר.כאשר האנזים פעיל, יכולות להיקשר אליו ארבע מולוקולת של לקטוז, אחת בכל אתר פעיל. |
<br> | <br> | ||
האתרים הפעילים פועלים באופן עצמאי, אך פעילותם תלויה במבנה התקין של הטטרמר. | האתרים הפעילים פועלים באופן עצמאי, אך פעילותם תלויה במבנה התקין של הטטרמר. | ||
| Line 100: | Line 103: | ||
ישנם מספר <scene name='89/898980/Mg_and_na/1'>יוני נתרן ומגנזיום</scene> הקשורים לחומצות אמיניות שונות בחלבון. תפקידם ככל הנראה לאפשר ייצוב של המבנה המרחבי של כל אחד משני הדימרים המרכיבים את הטטרמר, | ישנם מספר <scene name='89/898980/Mg_and_na/1'>יוני נתרן ומגנזיום</scene> הקשורים לחומצות אמיניות שונות בחלבון. תפקידם ככל הנראה לאפשר ייצוב של המבנה המרחבי של כל אחד משני הדימרים המרכיבים את הטטרמר, | ||
<br> | <br> | ||
| - | ביניהם <scene name='89/898980/Active_site_mg/1'>יון מגנזיום הקשור באתר הפעיל</scene> (צבוע בצבע אדום) מאפשר פעילות מיטבית של האנזים . | + | ביניהם <scene name='89/898980/Active_site_mg/1'>יון מגנזיום הקשור באתר הפעיל</scene> (צבוע בצבע אדום )מאפשר פעילות מיטבית של האנזים. <ref name="Douglas h. juers"/> <ref name="NCBI"> https://www.ncbi.nlm.nih.gov/protein/P00722.2 חלבון בטא-גלקטוזידאז - NCBI </ref> |
| + | <br> | ||
</p> | </p> | ||
| Line 133: | Line 137: | ||
<br> | <br> | ||
הדוגמא באיור 3 מציגה עימוד של האנזים בטא-גלקטוזידאז בחיידקים שונים, בהשוואה לחיידק | הדוגמא באיור 3 מציגה עימוד של האנזים בטא-גלקטוזידאז בחיידקים שונים, בהשוואה לחיידק | ||
| - | ''E.coli'', אשר נמצא בשורה הראשונה. '''עמדות שמורות המסומנות באדום''' הן עמדות חשובות בתפקוד החלבון. | + | ''E.coli'', אשר נמצא בשורה הראשונה. '''עמדות שמורות המסומנות באדום''' הן עמדות חשובות בתפקוד החלבון. <ref name="NCBI"/> <ref> https://www.rcsb.org/structure/1DP0 מבנה החלבון בטא-גלקטוזידאז - PDB </ref> |
[[Image:Imud.PNG|thumb|center|560px|איור 3: תוצאות עימוד בטא-גלקטוזידאז]] | [[Image:Imud.PNG|thumb|center|560px|איור 3: תוצאות עימוד בטא-גלקטוזידאז]] | ||
</p> | </p> | ||
| Line 167: | Line 171: | ||
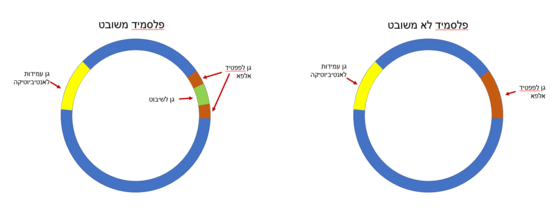
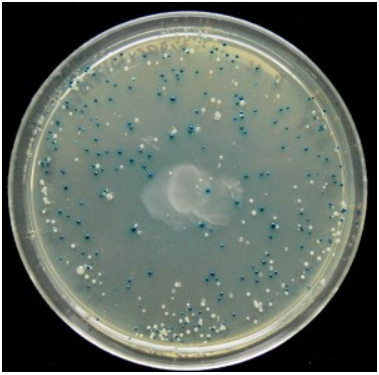
מושבות חיידקים לבנות יעידו על הצלחת השיבוט (משמעות הצבע הלבן היא שלא נוצר פפטיד אלפא ולכן האנזים אינו פעיל ולא נגרם פירוק של ה X-gal במצע). | מושבות חיידקים לבנות יעידו על הצלחת השיבוט (משמעות הצבע הלבן היא שלא נוצר פפטיד אלפא ולכן האנזים אינו פעיל ולא נגרם פירוק של ה X-gal במצע). | ||
<br> | <br> | ||
| - | העובדה שהתפתחו מושבות על גבי המצע, הכולל אנטיביוטיקה, שוללת אפשרות לטעון שמה שנכשל הוא החדרת הפלסמיד כיוון שתכונת העמידות לאנטיביוטיקה הוחדרה באמצעות הפלסמיד. | + | העובדה שהתפתחו מושבות על גבי המצע, הכולל אנטיביוטיקה, שוללת אפשרות לטעון שמה שנכשל הוא החדרת הפלסמיד כיוון שתכונת העמידות לאנטיביוטיקה הוחדרה באמצעות הפלסמיד. <ref name="Douglas h. juers"/> |
</p> | </p> | ||
<br> | <br> | ||
| Line 175: | Line 179: | ||
בשיטה זו בודקים את הבקרה על ביטוי של גנים. | בשיטה זו בודקים את הבקרה על ביטוי של גנים. | ||
<br> | <br> | ||
| - | משבטים את הגן לבטא גלקטוזידאז המלא במורד הזרם מפרומוטור שאת דגם ביטויו רוצים לבדוק.לאחר חשיפה ל X-gal ניתן לראות באילו תנאים או מצבים הגן מתבטא, מה שמעיד על פרומוטור פעיל. | + | משבטים את הגן לבטא גלקטוזידאז המלא במורד הזרם מפרומוטור שאת דגם ביטויו רוצים לבדוק. |
| + | <br> | ||
| + | לאחר חשיפה ל X-gal ניתן לראות באילו תנאים או מצבים הגן מתבטא, מה שמעיד על פרומוטור פעיל. | ||
<br> | <br> | ||
מושבות כחולות יעידו על תאים בהם הפרומוטור פעיל ומושבות לבנות יעידו על פרומוטור מושתק.(ראה איור 5) | מושבות כחולות יעידו על תאים בהם הפרומוטור פעיל ומושבות לבנות יעידו על פרומוטור מושתק.(ראה איור 5) | ||
| Line 182: | Line 188: | ||
<br> | <br> | ||
==<center>'''דף עבודה לתלמיד'''</center>== | ==<center>'''דף עבודה לתלמיד'''</center>== | ||
| - | + | <center>[https://proteopedia.org/wiki/images/8/8c/%D7%93%D7%A3_%D7%A2%D7%91%D7%95%D7%93%D7%94_%D7%91%D7%98%D7%90-%D7%92%D7%9C%D7%A7%D7%98%D7%95%D7%96%D7%99%D7%93%D7%90%D7%96_%D7%9C%D7%AA%D7%9C%D7%9E%D7%99%D7%93.pdf דף עבודה לתלמיד]</center> | |
</StructureSection> | </StructureSection> | ||
| - | == מקורות מידע == | + | == <center>''' מקורות מידע '''</center> == |
<references/> | <references/> | ||
| - | 1. Douglas H.Juers, Raymond H.Jacobson, Dale Wigley, Xue-Jun Zhang, Reuben E.Huber, Dale E.Tronrud and Brian W.Matthews (2000) , High resolution refinement of b-galactosidase in a new crystal form reveals multiple metal-binding sites and provides a structural basis for a-complementation, Protein Science 9:1685–1699. Cambridge University Press. Printed in the USA | ||
| - | https://pubmed.ncbi.nlm.nih.gov/11045615/ | ||
| - | <br> | ||
| - | 2. Douglas H. Juers, Brian W. Matthews, and Reuben E. Huber, | ||
| - | LacZ b-galactosidase: Structure and function of an enzyme of historical and molecular biological importance, Protein Sci 2012 Dec;21(12):1792-807. doi: 10.1002/pro.2165. Epub 2012 Nov 13. | ||
| - | https://pubmed.ncbi.nlm.nih.gov/23011886/ | ||
| - | <br> | ||
| - | 3. https://www.rcsb.org/structure/1DP0 מבנה החלבון בטא-גלקטוזידאז - PDB | ||
| - | <br> | ||
| - | 4. https://www.ncbi.nlm.nih.gov/protein/P00722.2 חלבון בטא-גלקטוזידאז - NCBI | ||
| - | <br> | ||
| - | 5. בטא-גלקטוזידאז באתר ויקירפואה:[https://www.wikirefua.org.il/w/index.php/%D7%91%D7%98%D7%90-%D7%92%D7%9C%D7%A7%D7%98%D7%95%D7%96%D7%99%D7%93%D7%90%D7%96_-_Beta-galactosidase#.D7.AA.D7.A8.D7.97.D7.99.D7.A9.D7.99.D7.9D_.D7.A7.D7.9C.D7.99.D7.A0.D7.99.D7.99.D7.9D_.D7.91.D7.97.D7.A1.D7.A8_.D7.94.D7.90.D7.A0.D7.96.D7.99.D7.9D] | ||
Current revision
בטא-גלקטוזידאז
| |||||||||||
מקורות מידע
- ↑ Douglas H.Juers, Raymond H.Jacobson, Dale Wigley, Xue-Jun Zhang, Reuben E.Huber, Dale E.Tronrud and Brian W.Matthews (2000) , High resolution refinement of b-galactosidase in a new crystal form reveals multiple metal-binding sites and provides a structural basis for a-complementation, Protein Science 9:1685–1699. Cambridge University Press. Printed in the USA https://pubmed.ncbi.nlm.nih.gov/11045615/
- ↑ 2.0 2.1 2.2 Douglas H. Juers, Brian W. Matthews, and Reuben E. Huber, LacZ b-galactosidase: Structure and function of an enzyme of historical and molecular biological importance, Protein Sci 2012 Dec;21(12):1792-807. doi: 10.1002/pro.2165. Epub 2012 Nov 13. https://pubmed.ncbi.nlm.nih.gov/23011886/
- ↑ בטא-גלקטוזידאז באתר ויקירפואה:[1]
- ↑ אופרון הלקטוז באתר דוידסון אונליין: [2]
- ↑ יהודית עתידיה (2001), גנטיקה, האוניברסיטה העברית, משרד החינוך ומטה מל"מ. 171-174
- ↑ 6.0 6.1 https://www.ncbi.nlm.nih.gov/protein/P00722.2 חלבון בטא-גלקטוזידאז - NCBI
- ↑ https://www.rcsb.org/structure/1DP0 מבנה החלבון בטא-גלקטוזידאז - PDB