DD-transpeptidase (Hebrew)
From Proteopedia
(Difference between revisions)
| (2 intermediate revisions not shown.) | |||
| Line 11: | Line 11: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
גודל [https://www.youtube.com/watch?v=aFwOfiPlSdc האנזים] טרנספפטידאז הוא 37.5 קילו דלתון והוא בנוי מ406 [https://www.youtube.com/watch?v=gpu2AUW4S5g&ab_channel=ComGeek חומצות אמינו]. בדגם שגובש ומוצג בערך זה יש את <scene name='89/898977/Amino_acids/2'>347 חומצות האמינו</scene> (בסצנה שלפניכם כל צבע מייצג יותר מחומצה אמינית אחת) המייצגות את החלבון הפעיל (עמדות 32-380) <ref name="PDB">[https://www.rcsb.org/structure/3PTE PDB]</ref>. המקטע שלא גובש כולל שרשרת פפטידית של 31 חומצות אמינו (1-31) בקצה ה-N טרמינלי של החלבון הנחתכת מהחלבון לאחר שהוא מגיע ליעדו בדופן התא, ועוד מקטע של 26 חומצות אמינו (381-406) הנחתך מהחלבון לאחר אקטיבציה<ref name="UNIPROT">[https://www.uniprot.org/uniprot/P15555 UNIPROT]</ref>. 60% מהחלבון מורכב משרשראות פוליפפטידיות בעלות [https://youtu.be/K2bCx3xQeJE?t=87 מבנה שניוני] (<scene name='89/898977/Secondary_structures/1'>סלילי אלפא ומשטחי בטא</scene>). האתר הפעיל של האנזים נוצר ע"י 4 חומצות אמינו בסיסיות ועוד 4 חומצות אמינו ארומטיות כאשר סרין במיקום 62 היא החומצה האמינית אשר קושרת אליה את הסובסטרט<ref name="PUBMED">[https://pubmed.ncbi.nlm.nih.gov/7490745/ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution]</ref>. | גודל [https://www.youtube.com/watch?v=aFwOfiPlSdc האנזים] טרנספפטידאז הוא 37.5 קילו דלתון והוא בנוי מ406 [https://www.youtube.com/watch?v=gpu2AUW4S5g&ab_channel=ComGeek חומצות אמינו]. בדגם שגובש ומוצג בערך זה יש את <scene name='89/898977/Amino_acids/2'>347 חומצות האמינו</scene> (בסצנה שלפניכם כל צבע מייצג יותר מחומצה אמינית אחת) המייצגות את החלבון הפעיל (עמדות 32-380) <ref name="PDB">[https://www.rcsb.org/structure/3PTE PDB]</ref>. המקטע שלא גובש כולל שרשרת פפטידית של 31 חומצות אמינו (1-31) בקצה ה-N טרמינלי של החלבון הנחתכת מהחלבון לאחר שהוא מגיע ליעדו בדופן התא, ועוד מקטע של 26 חומצות אמינו (381-406) הנחתך מהחלבון לאחר אקטיבציה<ref name="UNIPROT">[https://www.uniprot.org/uniprot/P15555 UNIPROT]</ref>. 60% מהחלבון מורכב משרשראות פוליפפטידיות בעלות [https://youtu.be/K2bCx3xQeJE?t=87 מבנה שניוני] (<scene name='89/898977/Secondary_structures/1'>סלילי אלפא ומשטחי בטא</scene>). האתר הפעיל של האנזים נוצר ע"י 4 חומצות אמינו בסיסיות ועוד 4 חומצות אמינו ארומטיות כאשר סרין במיקום 62 היא החומצה האמינית אשר קושרת אליה את הסובסטרט<ref name="PUBMED">[https://pubmed.ncbi.nlm.nih.gov/7490745/ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution]</ref>. | ||
| - | </p> | + | </p> |
| - | + | ||
<p dir='rtl'> | <p dir='rtl'> | ||
באתר הפעיל יש <scene name='89/898977/Conserved_aa/2'> 8 חומצות אמינו </scene> הנמצאו שמורות אבולוציונית בכל סוגי האנזימים ממשפחת [https://iw.strephonsays.com/protease-and-vs-peptidase-4913 הפפטידאזות]. חומצות אמינו אלו ממוקמות בשלושה אזורים שונים באתר הפעיל והן יוצרות את <scene name='89/898977/Catalytic_pocket/1'>הכיס הקטליטי</scene> של האנזים. <scene name='89/898977/Active_site/3'>סרין 62 וליזין 65 </scene> אחראיות לתגובה הכימית עם הסובסטראט<ref name="WIKI1">[https://en.wikipedia.org/wiki/DD-transpeptidase Wikipedia: DD-transpeptidase]</ref>, ושתי הקבוצות: טירוזין159-סרין160-אספרגין161, היסטידין298-תראונין299-גליצין300, הן חלק מ<scene name='89/898977/Binding_sites/1'>אתרי הקישור לסובסטרט</scene>. | באתר הפעיל יש <scene name='89/898977/Conserved_aa/2'> 8 חומצות אמינו </scene> הנמצאו שמורות אבולוציונית בכל סוגי האנזימים ממשפחת [https://iw.strephonsays.com/protease-and-vs-peptidase-4913 הפפטידאזות]. חומצות אמינו אלו ממוקמות בשלושה אזורים שונים באתר הפעיל והן יוצרות את <scene name='89/898977/Catalytic_pocket/1'>הכיס הקטליטי</scene> של האנזים. <scene name='89/898977/Active_site/3'>סרין 62 וליזין 65 </scene> אחראיות לתגובה הכימית עם הסובסטראט<ref name="WIKI1">[https://en.wikipedia.org/wiki/DD-transpeptidase Wikipedia: DD-transpeptidase]</ref>, ושתי הקבוצות: טירוזין159-סרין160-אספרגין161, היסטידין298-תראונין299-גליצין300, הן חלק מ<scene name='89/898977/Binding_sites/1'>אתרי הקישור לסובסטרט</scene>. | ||
| + | </p> | ||
| + | <p dir='rtl'> | ||
| + | בנוסף, חלבון זה מכיל 2 חומצות אמינו מסוג ציסטאין, המכילות אטום גופרית בשייר שלהן. בין 2 אטומי גופרית אלו נוצרים קשרי S-S, המכונים גם [https://he.wikipedia.org/wiki/%D7%A7%D7%A9%D7%A8_%D7%93%D7%99%D7%A1%D7%95%D7%9C%D7%A4%D7%99%D7%93%D7%99 קשרים דיסולפידים] או קשרי גופרית, והם תורמים רבות לייצוב המבנה השלישוני של החלבון<ref name="WIKI4">[https://he.wikipedia.org/wiki/%D7%A6%D7%99%D7%A1%D7%98%D7%90%D7%99%D7%9F ויקיפדיה: ציסטאין]</ref>. מיקומו של הקשר הדיסולפידי בחלבון מסומן בקו צהוב וניתן לראותו בסצנה המתארת את <scene name='89/898977/Binding_sites/1'>אתרי הקישור לסובסטרט</scene>. | ||
</p> | </p> | ||
| Line 26: | Line 29: | ||
===<div style="text-align:right;direction:rtl;">'''השפעת אנטיביוטיקה מסוג פניצילין על האנזים טרנספפטידאז'''</div>=== | ===<div style="text-align:right;direction:rtl;">'''השפעת אנטיביוטיקה מסוג פניצילין על האנזים טרנספפטידאז'''</div>=== | ||
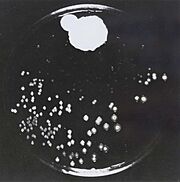
| - | [[Image:Penicillin fleming.jpg |thumb|left|תמונה מס. | + | [[Image:Penicillin fleming.jpg |thumb|left|תמונה מס. 2: היעדר מושבות של חיידקים בסביבת הפניציליום]] |
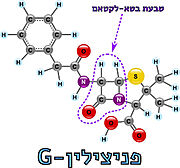
| - | [[Image:Beta-lactam2.jpg |thumb|left|תמונה מס. | + | [[Image:Beta-lactam2.jpg |thumb|left|תמונה מס. 3: מבנה טבעת הבטא-לקטאם]] |
<p dir='rtl'> | <p dir='rtl'> | ||
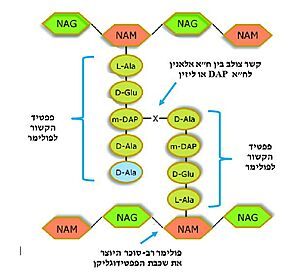
| - | [https://www.hamichlol.org.il/%D7%A4%D7%A0%D7%99%D7%A6%D7%99%D7%9C%D7%99%D7%9F פניצילין] הוא שם כולל לקבוצת חומרים אנטיביוטיים המעכבים את תהליך יצירת דופן התא על ידי עיכוב האנזים טרנספפטידאז. הפניצילין התגלה על ידי [https://davidson.weizmann.ac.il/online/sciencehistory/%D7%94%D7%99%D7%95%D7%9D-%D7%9C%D7%A4%D7%A0%D7%99-%D7%90%D7%9C%D7%9B%D7%A1%D7%A0%D7%93%D7%A8-%D7%A4%D7%9C%D7%9E%D7%99%D7%A0%D7%92 אלכסנדר פלמינג] בשנת 1928 (תמונה מס. | + | [https://www.hamichlol.org.il/%D7%A4%D7%A0%D7%99%D7%A6%D7%99%D7%9C%D7%99%D7%9F פניצילין] הוא שם כולל לקבוצת חומרים אנטיביוטיים המעכבים את תהליך יצירת דופן התא על ידי עיכוב האנזים טרנספפטידאז. הפניצילין התגלה על ידי [https://davidson.weizmann.ac.il/online/sciencehistory/%D7%94%D7%99%D7%95%D7%9D-%D7%9C%D7%A4%D7%A0%D7%99-%D7%90%D7%9C%D7%9B%D7%A1%D7%A0%D7%93%D7%A8-%D7%A4%D7%9C%D7%9E%D7%99%D7%A0%D7%92 אלכסנדר פלמינג] בשנת 1928 (תמונה מס. 2), ובהמשך פותחה הטכנולוגיה המאפשרת להפיק את החומר מפטריית העובש [https://www.familyhandyman.com/article/what-to-know-about-penicillium-mold/ פניציליום]. כיום ניתן לייצר גם פניצילינים סינתטיים-למחצה, כאשר המשותף לכל סוגי הפניצילינים הוא קיומה של מבנה טבעת הבטא-לקטם במולקולה; מבנה טבעתי המכיל 3 אטומי פחמן ואטום חנקן אחד (תמונה מס. 3)<ref name="WIKI2">[https://he.wikipedia.org/wiki/%D7%A4%D7%A0%D7%99%D7%A6%D7%99%D7%9C%D7%99%D7%9F#%D7%9B%D7%99%D7%9E%D7%99%D7%94 ויקיפדיה: פניצילין]</ref> <ref name="WIKI3">[https://he.wikipedia.org/wiki/%D7%9C%D7%A7%D7%98%D7%9D ויקיפדיה: לקטאם]</ref>. |
טבעת הבטא-לקטם דומה במבנה המרחבי ובהרכבה הכימי לצמד חומצות האמינו אלאנין המצויות בקצה הפפטיד בדופן הפפטידוגליקן. דמיון זה מאפשר לטבעת הבטא-לקטם להיקשר לחומצה האמינית סרין הממוקמת באתר הפעיל של האנזים טרנספפטידאז. עם זאת, בניגוד לתגובה המתרחשת בין הפפטיד לטרנספפטידאז המאפשרת את יצירת הקשר הצולב והתנתקות של האנזים לאחר מכן, טבעת הבטא-לקטם נפתחת ויוצרת קשר קוולנטי עם הח"א סרין שבאתר הפעיל, ובכך מעכבת את פעילות האנזים באופן [https://sites.google.com/site/enzymeinh/def/inh/rev בלתי הפיך]. מכיוון שטבעת הבטא-לקטם במולקולת הפניצילין נקשרת לאתר הפעיל באנזים, היא נחשבת ל[https://www.youtube.com/watch?v=sByPvdzUNsU&ab_channel=%D7%9E%D7%9B%D7%95%D7%9F%D7%93%D7%95%D7%99%D7%93%D7%A1%D7%95%D7%9F-%D7%A1%D7%A8%D7%98%D7%95%D7%A0%D7%99%D7%9E%D7%93%D7%A2 מעכב תחרותי] המתחרה עם הפפטידוגליקן (הסובסטראט) על הקישור לאתר הפעיל <ref name="PUBMED2">[https://pubmed.ncbi.nlm.nih.gov/14692773/ A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins]</ref>. | טבעת הבטא-לקטם דומה במבנה המרחבי ובהרכבה הכימי לצמד חומצות האמינו אלאנין המצויות בקצה הפפטיד בדופן הפפטידוגליקן. דמיון זה מאפשר לטבעת הבטא-לקטם להיקשר לחומצה האמינית סרין הממוקמת באתר הפעיל של האנזים טרנספפטידאז. עם זאת, בניגוד לתגובה המתרחשת בין הפפטיד לטרנספפטידאז המאפשרת את יצירת הקשר הצולב והתנתקות של האנזים לאחר מכן, טבעת הבטא-לקטם נפתחת ויוצרת קשר קוולנטי עם הח"א סרין שבאתר הפעיל, ובכך מעכבת את פעילות האנזים באופן [https://sites.google.com/site/enzymeinh/def/inh/rev בלתי הפיך]. מכיוון שטבעת הבטא-לקטם במולקולת הפניצילין נקשרת לאתר הפעיל באנזים, היא נחשבת ל[https://www.youtube.com/watch?v=sByPvdzUNsU&ab_channel=%D7%9E%D7%9B%D7%95%D7%9F%D7%93%D7%95%D7%99%D7%93%D7%A1%D7%95%D7%9F-%D7%A1%D7%A8%D7%98%D7%95%D7%A0%D7%99%D7%9E%D7%93%D7%A2 מעכב תחרותי] המתחרה עם הפפטידוגליקן (הסובסטראט) על הקישור לאתר הפעיל <ref name="PUBMED2">[https://pubmed.ncbi.nlm.nih.gov/14692773/ A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins]</ref>. | ||
</p> | </p> | ||
| Line 35: | Line 38: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
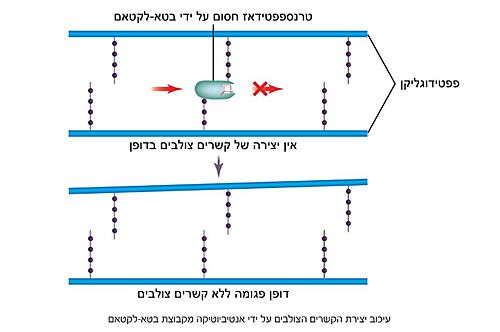
| - | האנזים טרנספפטידאז פוגע בעיקר בחיידקים הנמצאים בשלב חלוקת התא, במהלכו דופן החיידקים שהתחלקו נבנית מחדש. מסיבה זו, אנטיביוטיקה מסוג פניצילין משפיעה בעיקר על חיידקים מתחלקים, שכן בחיידקים שאינם מתחלקים הדופן כבר בנויה והאנזים טרנספפטידאז כמעט ואינו פעיל. בחשיפה לאנטיביוטיקה מסוג פניצילין לא נוצרים קשרים צולבים בדופן הפפטידוגליקן כתוצאה מעיכוב תחרותי ובלתי הפיך של האנזים טרנספפטידאז, ומבנה הדופן נפגם (תמונה מס. | + | האנזים טרנספפטידאז פוגע בעיקר בחיידקים הנמצאים בשלב חלוקת התא, במהלכו דופן החיידקים שהתחלקו נבנית מחדש. מסיבה זו, אנטיביוטיקה מסוג פניצילין משפיעה בעיקר על חיידקים מתחלקים, שכן בחיידקים שאינם מתחלקים הדופן כבר בנויה והאנזים טרנספפטידאז כמעט ואינו פעיל. בחשיפה לאנטיביוטיקה מסוג פניצילין לא נוצרים קשרים צולבים בדופן הפפטידוגליקן כתוצאה מעיכוב תחרותי ובלתי הפיך של האנזים טרנספפטידאז, ומבנה הדופן נפגם (תמונה מס. 4). היעדר הדופן הקשיחה גורר מצב שבו בסביבה [https://lo.cet.ac.il/player/?document=62ede947-12c3-45a1-bcad-639a9cae0368&language=he&sitekey=ebaghigh היפוטונית] - בה ריכוז המומסים מחוץ לתא קטן מריכוזם בתא (תמיסה מהולה) - מים יחדרו לתוך תא החיידק ויווצר לחץ על קרום התא עד להתפוצצותו. באופן זה גורמת החשיפה לפניצילין למוות של החיידקים הנמצאים בשלבי חלוקה בזמן החשיפה<ref name="WIEZMANN">[https://bioteach.org.il/%D7%A2%D7%9C%D7%95%D7%A0%D7%99%D7%9D-2002/%D7%AA%D7%95%D7%9B%D7%9F-%D7%A2%D7%99%D7%95%D7%A0%D7%99/%D7%A0%D7%95%D7%A9%D7%90%D7%99-%D7%94%D7%A2%D7%9E%D7%A7%D7%94-1/%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D/%D7%9E%D7%A7%D7%95%D7%A8%D7%95%D7%AA-%D7%9E%D7%99%D7%93%D7%A2-22/3573-%D7%A1%D7%A4%D7%A8-%D7%93%D7%99%D7%92%D7%99%D7%98%D7%9C%D7%99-%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D-2016 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016]</ref>. |
| - | [[Image:Penicillin activity.jpg|500 px|thumb|תמונה מס. | + | [[Image:Penicillin activity.jpg|500 px|thumb|תמונה מס. 4: פעילות האנזים טרנספפטידאז]] |
</p> | </p> | ||
<br> | <br> | ||
Current revision
טרנספפטידאז
| |||||||||||
קבצים מצורפים
ביבליוגרפיה
- ↑ PDB
- ↑ UNIPROT
- ↑ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution
- ↑ Wikipedia: DD-transpeptidase
- ↑ ויקיפדיה: ציסטאין
- ↑ 6.0 6.1 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016
- ↑ 7.0 7.1 A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins
- ↑ ויקיפדיה: פניצילין
- ↑ ויקיפדיה: לקטאם