User:María Sánchez Morán/TFGParte3
From Proteopedia
| (16 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
{| | {| | ||
| + | <p style="font-size 16px;text-align:center;"> | ||
| + | [[User:María_Sánchez_Morán/TFG | Índice]] | | ||
| + | [[User:María_Sánchez_Morán/TFGParte2| << Página Anterior]] | | ||
| + | [[User:María_Sánchez_Morán/TFGParte4 | Página Siguiente >>]] | ||
| + | </p> | ||
<div style=position:relative;margin-left:auto;margin-right:auto;padding:10px;border:1px solid #ededed;background-color:#FFFAFA;box-shadow:0px 0px 10px #ededed;"> | <div style=position:relative;margin-left:auto;margin-right:auto;padding:10px;border:1px solid #ededed;background-color:#FFFAFA;box-shadow:0px 0px 10px #ededed;"> | ||
<div id="punto5"></div> | <div id="punto5"></div> | ||
<p style="font-size:20px;border-bottom:1px solid #ac9de3;background-color:#E0DEFF;padding:5px;"> 5. Ciclo de los estados S </p> | <p style="font-size:20px;border-bottom:1px solid #ac9de3;background-color:#E0DEFF;padding:5px;"> 5. Ciclo de los estados S </p> | ||
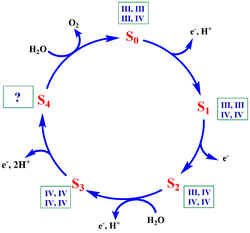
| - | + | [[Image:Fig4 MSM.png|thumb|left|250px| Fig. 3. Esquema general en el que se muestra los datos conocidos y demostrados del S-state cycle. Tomado de 18]] | |
<div id="punto51"></div> | <div id="punto51"></div> | ||
<p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">5.1. Visión general</p> | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">5.1. Visión general</p> | ||
| - | Se ha demostrado que para que se dé la formación de oxígeno molecular en el PSII, éste debe ser sometido a cuatro impulsos luminosos de luz. Este proceso se ha interpretado como un ciclo catalítico (Fig. | + | Se ha demostrado que para que se dé la formación de oxígeno molecular en el PSII, éste debe ser sometido a cuatro impulsos luminosos de luz. Este proceso se ha interpretado como un ciclo catalítico (Fig. 3) que consiste en cinco estados principales (de S<sub>0</sub> a S<sub>4</sub>) en los que se van acumulando, con cada impulso luminoso, equivalentes de oxidación de aproximadamente el mismo potencial, que se almacenan en los iones Mn del centro catalítico. [17] |
| - | En el estado | + | En el estado S<sub>3</sub>, justo antes de la última captación de fotones, el clúster tiene una configuración en la que los cuatro iones son Mn (IV). El estado S<sub>4</sub> acumula los cuatro equivalentes de oxidación necesarios para la oxidación de dos moléculas de agua a O<sub>2</sub>, tras la cual vuelve al estado S<sub>0</sub>. [16] |
| - | El mecanismo de formación del enlace O-O de la molécula de | + | El mecanismo de formación del enlace O-O de la molécula de O<sub>2</sub> aún no se conoce al detalle debido a la complejidad del entorno proteico, a los cambios estructurales que se producen en el OEC durante la reacción y a la gran velocidad a la que ocurre. [17,18] No obstante, diversos grupos de investigación, basándose en los datos anteriormente mencionados, han estudiado el ciclo con distintas metodologías y han presentado modelos por los que podrían producirse cada una de las etapas, los cuales se presentan a continuación. |
<div id="punto52"></div> | <div id="punto52"></div> | ||
<p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">5.2. Propuesta del grupo de Barber</p> | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">5.2. Propuesta del grupo de Barber</p> | ||
| - | Para desarrollar esta propuesta, el grupo de Barber se ha basado en las similitudes estructurales | + | <StructureSection load= size='350' side='right' caption='Estructuras propuestas por el grupo de Barber,' scene=''><scene name='90/902774/Abarber_msm/7'></scene> |
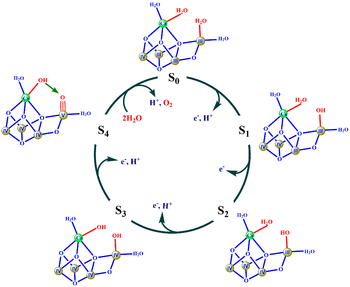
| + | [[Image:FigBMSM.png|thumb|350px|right| Fig. 4. Mecanismo propuesto por el grupo de Barber. En rojo, los cambios más significativos durante el ciclo catalítico. En círculos sombreados, los átomos de Mn con sus estados de oxidación expresados en números romanos. En verde, el átomo de Ca. Tomado de 18]] | ||
| + | |||
| + | Para desarrollar esta propuesta, el grupo de Barber se ha basado en las similitudes estructurales existentes entre el OEC y la enzima carbono monóxido deshidrogenasa que contiene hierro y níquel (Fe-Ni CODH). Esta enzima consiste en un cubano Fe<sub>3</sub>NiS<sub>4</sub> unido a un cuarto Fe vía puente de sulfuro, formando el clúster Fe<sub>4</sub>NiS<sub>5</sub>, que tiene un mecanismo conocido basado en un ataque nucleófilo catalizado por una base. [17] | ||
| + | |||
| + | En el caso del OEC, se propone la formación del enlace O-O como consecuencia de un ataque nucleófilo de un grupo hidroxilo, que se encuentra ligado al átomo de calcio, a un átomo de oxígeno con carácter electrófilo, unido a un manganeso en alto estado de oxidación. [17, 18] A continuación se presentan las características más importantes de este <scene name='90/902774/Abarber_msm/7'>mecanismo</scene>, que también quedan reflejadas en la Figura 4. | ||
*Este mecanismo depende de que Mn4 alcance un alto estado de oxidación en S<sub>4</sub> y, de esta forma, que el oxígeno unido a él sea deficiente electrónicamente. | *Este mecanismo depende de que Mn4 alcance un alto estado de oxidación en S<sub>4</sub> y, de esta forma, que el oxígeno unido a él sea deficiente electrónicamente. | ||
| Line 29: | Line 39: | ||
*De S<sub>1</sub> a S<sub>2</sub> se produce la oxidación de Mn3(III) a Mn3(IV). | *De S<sub>1</sub> a S<sub>2</sub> se produce la oxidación de Mn3(III) a Mn3(IV). | ||
| - | *En el paso de | + | *En el paso de S<sub>2</sub> a S<sub>3</sub> se produce desprotonación de una molécula de agua sustrato y la oxidación de Mn4(III) a Mn4(IV), alcanzando en S<sub>3</sub> una configuración Mn (IV, IV, IV, IV). |
| - | *De S<sub>3</sub> a S<sub>4</sub> debe producirse una nueva oxidación de Mn4(IV) a Mn4(V) y una segunda desprotonación de la molécula de agua unida a Mn4. Esto provocaría que en el estado | + | *De S<sub>3</sub> a S<sub>4</sub> debe producirse una nueva oxidación de Mn4(IV) a Mn4(V) y una segunda desprotonación de la molécula de agua unida a Mn4. Esto provocaría que en el estado S<sub>4</sub> aparezca un grupo Mn<sup>V</sup>≡O, donde el átomo de oxígeno es deficiente electrónicamente y, por tanto, tiene carácter electrófilo. |
| - | *En la transición de S<sub>4</sub> a S<sub>0</sub>, el hidróxido unido al calcio ataca al oxígeno del grupo | + | *En la transición de S<sub>4</sub> a S<sub>0</sub>, el hidróxido unido al calcio ataca al oxígeno del grupo Mn<sup>V</sup>≡O para formar el enlace O-O. Finalmente, una última desprotonación y la incorporación de dos nuevas moléculas sustrato de agua permiten la liberación de O<sub>2</sub> y la reestructuración del estado S<sub>0</sub>. |
En esta propuesta se sugiere la presencia de Mn(V) en el estado S<sub>4</sub>, que no ha sido identificado experimentalmente en el OEC, aunque cabría la posibilidad de que se deba al corto periodo de vida del S<sub>4</sub>. [17] En contra tiene también los cálculos teóricos realizados posteriormente, que han demostrado la inviabilidad de este mecanismo por las altas barreras energéticas que presenta. [18,19] | En esta propuesta se sugiere la presencia de Mn(V) en el estado S<sub>4</sub>, que no ha sido identificado experimentalmente en el OEC, aunque cabría la posibilidad de que se deba al corto periodo de vida del S<sub>4</sub>. [17] En contra tiene también los cálculos teóricos realizados posteriormente, que han demostrado la inviabilidad de este mecanismo por las altas barreras energéticas que presenta. [18,19] | ||
| - | <p style="font-size | + | {{PlayButtons}} |
| + | |||
| + | {{ColorKey MnCaOH}} | ||
| + | </StructureSection> | ||
| + | |||
| + | |||
| + | <p style="font-size 16px;text-align:center;"> | ||
[[User:María_Sánchez_Morán/TFG | Índice]] | | [[User:María_Sánchez_Morán/TFG | Índice]] | | ||
[[User:María_Sánchez_Morán/TFGParte2| << Página Anterior]] | | [[User:María_Sánchez_Morán/TFGParte2| << Página Anterior]] | | ||
Current revision
| |||||||||||