Cytochrome C (arabic)
From Proteopedia
(Difference between revisions)
| (19 intermediate revisions not shown.) | |||
| Line 7: | Line 7: | ||
</p> | </p> | ||
<StructureSection load='1J3S' size='340' side='left' caption=' سيتوكروم سي البشري (PDB code [[1j3s]])' scene='89/898985/Cytochrome_c_basic/19'> | <StructureSection load='1J3S' size='340' side='left' caption=' سيتوكروم سي البشري (PDB code [[1j3s]])' scene='89/898985/Cytochrome_c_basic/19'> | ||
| - | + | ==<div style="text-align: right;"> المقدمة </div> == | |
| - | ==<div style="text-align: right;"> | + | |
<p dir='rtl'> | <p dir='rtl'> | ||
سيتوكروم سي عبارة عن بروتين رئيسي في سلسلة نقل الالكترونات، والتي هي العملية الأخيرة في عملية | سيتوكروم سي عبارة عن بروتين رئيسي في سلسلة نقل الالكترونات، والتي هي العملية الأخيرة في عملية | ||
| Line 33: | Line 32: | ||
[https://youtu.be/YZsJ-8TenYw סרטון] فيديو عن انحدار التراكيز مع التركيز على ATP سينثاز. | [https://youtu.be/YZsJ-8TenYw סרטון] فيديو عن انحدار التراكيز مع التركيز على ATP سينثاز. | ||
</p> | </p> | ||
| - | |||
| - | |||
| - | |||
==<div style="text-align: right;"> المبنى الجزيئي </div> == | ==<div style="text-align: right;"> المبنى الجزيئي </div> == | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| Line 48: | Line 44: | ||
<br> | <br> | ||
صورة 2 | صورة 2 | ||
| - | [[Image:Consurf key small.gif|center|300px| | + | [[Image:Consurf key small.gif|center|300px|مفتاح الأوان لعرض الحفظ التطوري- الليلكي الداكن يعرض الاحماض الامينية المحفوظة تطوريا والمتماثلة بكائنات حية مختلفة. الأبيض يعرض الاحماض الامينية المحفوظة بشكل جزئي والازرق يعرض الاحماض الامينية الغير محفوظة تطوريا حيث ان هذه المواقع تتواجد بالعديد من الاحماض الامينية المختلفة بين كائنات حية مختلفة. |
| - | + | ||
| - | + | ||
| - | + | ||
]] | ]] | ||
<br> | <br> | ||
<br> | <br> | ||
| - | + | </p> | |
| - | + | ||
| - | + | ||
==<div style="text-align: right;"> الوظيفة </div> == | ==<div style="text-align: right;"> الوظيفة </div> == | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | |||
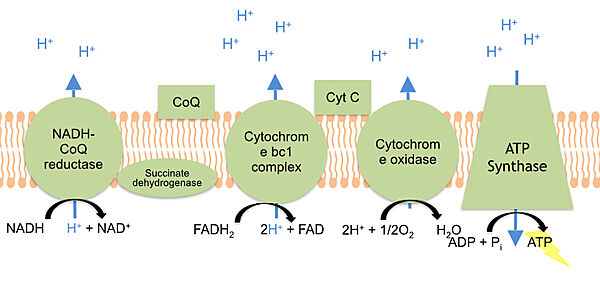
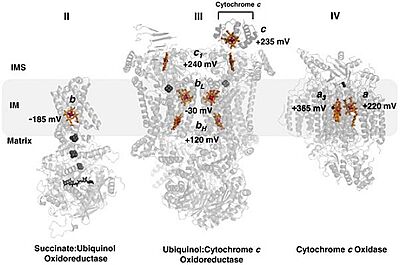
في سلسلة نقل الالكترونات يقوم سيتوكروم سي بنقل الكترون بين المعقدين III و IV . المعقد III يسمى سيتوكروم bc1 والمعقد IV يسمى سيتوكروم سي أوكسيداز. نقل الالكترونات يكون ممكنا بسبب حالة تأكسد متغيرة لذرة الحديد ، حيث ان في البداية يتواجد أيون الحديد في مجموعة هيم بحالة Fe3+ الأمر الذي يمكن من استيعاب الكترون واحد وبالتالي اختزال الحديد لحالة Fe2+. | في سلسلة نقل الالكترونات يقوم سيتوكروم سي بنقل الكترون بين المعقدين III و IV . المعقد III يسمى سيتوكروم bc1 والمعقد IV يسمى سيتوكروم سي أوكسيداز. نقل الالكترونات يكون ممكنا بسبب حالة تأكسد متغيرة لذرة الحديد ، حيث ان في البداية يتواجد أيون الحديد في مجموعة هيم بحالة Fe3+ الأمر الذي يمكن من استيعاب الكترون واحد وبالتالي اختزال الحديد لحالة Fe2+. | ||
<br> | <br> | ||
| Line 73: | Line 63: | ||
<br> | <br> | ||
<br> | <br> | ||
| - | + | في هذا [https://youtu.be/Od3pUsVdMhQ الفيديو] نرى دور السيتوكروم سي في موت الخلايا المبرمج. | |
<br> | <br> | ||
| - | + | سيتوكروم سي الحامل للإلكترونات يتواجد داخل الغشاء الداخلي للميتوكوندريا بواسطة رابط هيدروفوبي (كاره للماء) للفوسفوليبيد كارديوليبين (وهو جزيء هيدروفوبي يبني غشاء الميتوكوندريا). | |
<br> | <br> | ||
<br> | <br> | ||
| - | + | صورة 4 | |
</p> | </p> | ||
| - | [[Image:Cardiolipin.jpg|border|center|280px| | + | [[Image:Cardiolipin.jpg|border|center|280px|في الجهة اليسرى من الرسم نرى البروتين سيتوكروم سي مربوط مع الفوسوفليبيد كارديوليبين ويتواجد داخل الغشاء الداخلي للميتوكوندريا. في الجهة اليمنى نرى انقسام المعقد كارديوليبين- سيتوكروم سي نتيجة لتأكسد جزيء الكارديوليبين. سيتوكورم سي ينفصل عن الغشاء ويصبح حر ويمكنه الوصول للسيتوبلازما.]] |
<br> | <br> | ||
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
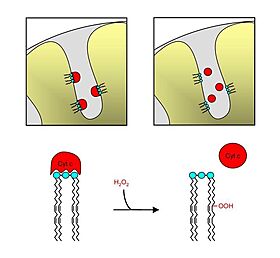
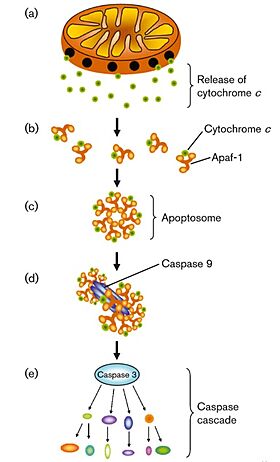
| - | + | تتميز بداية عملية الموت الخلوي بارتفاع في نسبة الشوارد الحرة (ROS) في الميتوكوندريا. نتيجة لذلك يتم تأكسد الكارديوليبين وبالتالي فانه يتم تفكيك المعقد كارديوليبين- سيتوكروم سي. | |
| + | يقوم بعد ذلك السيتوكروم سي بالخروج من الغشاء الداخلي للميتوكوندريا ويمر من خلال الثقوب الموجودة في الغشاء الخارجي وصولا الى السيتوبرلازما. في السيتوبلازما يرتبط سيتوكروم سي لبروتين APAF1 وبروتين dATP وهكذا يتكون مبنى ال أبوبتوسوم وهو بروتين يربط بروتين بروكسباز 9 ويحوله الى صورته النشطة والفعالة وهكذا تتمكن الكاسباسات 3 و7 من الارتباط والعمل (caspase). هذه العملية تؤدي الى ضرر وانقسام في ال DNA الذي ينتهي بموت موجه للخلية. | ||
<br> | <br> | ||
<br> | <br> | ||
| - | + | صورة 5 | |
</p> | </p> | ||
| - | [[Image:Apoptosome.jpg|border|center|280px| | + | [[Image:Apoptosome.jpg|border|center|280px|بداية نرى اطلاق السيتوكروم سي من الميتوكوندريا الى السيتوبلازما. بعد ذلك يرتبط السيتوكورم سي مع بروتين في السيتوبلازما ويتم انتاج الأبوبتوسوم وهو مركب مهم في مراقبة عملية الموت المبرمج للخلايا حيث انه يربط بروتين بروكسباز 9 ويحوله الى صورته النشطة والفعالة وهكذا ينشط المسار الداخلي لعملية الموت الخلوي والتي تنتهي بموت موجه للخلية.]] |
<br> | <br> | ||
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | منع الموت المبرمج للخلية | |
<br> | <br> | ||
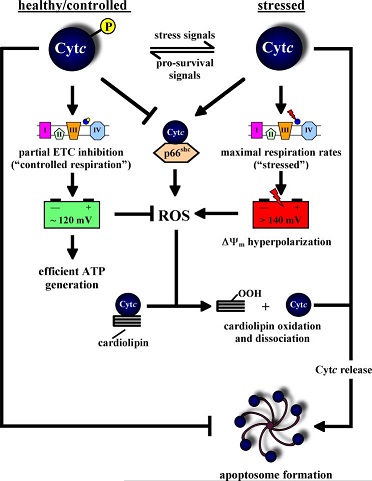
| - | + | تشير العديد من الأبحاث ان الخلايا تستطيع ان تتحكم وتسيطر على موت الخلايا المبرمج ولذك من خلال تعديل تقوم به بعد عملية الترجمة في البروتين. البروتينات هي سلسلة طويلة من الاحماض الامينية، المرحلة الأولى في بناء البروتين هي انتاج سلسلة من الاحماض الامينية (المبنى الاولي) وبعد ذلك تمر هذه السلسلة بالعديد من المعالجات والتعديلات. واحدة من هذه التعديلات هي عملية الفسفرة. عملية الفسفرة يتم فيها إضافة مجموعة فوسفات للبروتين (أيون يحتوي على ذرة فوسفات واحدة و4 ذرات هيدروجين). تتم العملية بواسطة إنزيمات الكيناز والتي تنقل الفوسفات وهي تغيير الشكل التركيبي للبروتين بحيث تعدل من صفاته أو وظيفته. والعملية العكسية تسمى إزالة الفسفرة بواسطة انزيم الفوسفاتيز الذي يقوم بإزالة مجموعة فوسفات من البروتين. في سيتوكروم سي وجد أن هناك عدد من الأحماض الأمينية المحفوظة تطوريًا والتي تمر <scene name='89/898985/Phosphotyrosine_48_97/4'>بعملية الفسفرة</scene> ، الامر الذي يمنع من الإنتاج الزائد للشوارد الحرة (ROS) | |
<br> | <br> | ||
<br> | <br> | ||
| - | + | صورة 6 | |
</p> | </p> | ||
| - | [[Image:Apoptosome formation.jpg|border|center| | + | [[Image:Apoptosome formation.jpg|border|center|يعرض لنا المخطط التالي البروتين سيتوكروم سي في حالته المفسفرة (مراقب) وفي الحالة الغير مفسفرة (غير مراقب). في الحالة المراقبة نرى ان وتيرة التنفس الخلوي متوازنة ولذلك تنتج كمية شوارد حرة صغيرة ، جهد الغشاء إيجابي والسيتوكروم سي يرتبط مع الغشاء الداخلي للميتوكوندريا بواسطة الكارديوليبين. |
| - | + | في الحالة الغير متوازنة يكون التنفس الخلوي بأعلى وتيرة له ونتيجة لذلك يصبح جهد الخلية سلبي ويتم انتاج الشوارد الحرة بشكل متزايد ونرى انفصال المعقد كارديوليبين-سيتوكروم سي. | |
| + | |||
]] | ]] | ||
<br> | <br> | ||
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | صورة 7 | |
</p> | </p> | ||
| - | [[Image:Cytochrome c alignment.jpg|border|center| | + | [[Image:Cytochrome c alignment.jpg|border|center| |
| + | نرى في المكان 14 و17 الحمض الأميني سيستئين مربوط برباط كوفلنتي (تساهمي) مع مجموعة هيم (الحرف سي ). في أماكن الأسهم توجد مناطق محفوظة تطوريا والتي تمر بتعديل بعد عملية الترجمة من بينها المكان 48 و 97 (الحمض الأميني تيروسين-الحرف واي ) | ||
| + | (سيتوكروم سي مأخوذ من انسان وفأر من نسيج جسدي ونسيج جنسي).]] | ||
<br> | <br> | ||
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | وظيفة السيتوكروم سي كمانع للأكسدة (تقليل ROS) تتم بشكل مباشر عن طريق إزالة الأكسيد الفائق O2- وماء الاكسجين (H2O2) من الميتوكوندريا كما هو موضح في الرسم التالي: | |
<br> | <br> | ||
<br> | <br> | ||
| - | + | صورة 8 | |
</p> | </p> | ||
[[Image:Antioxidante.png|center|]] | [[Image:Antioxidante.png|center|]] | ||
| Line 121: | Line 115: | ||
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | سيتوكروم سي هو بروتين يلعب دور مركزي في انتاج الطاقة في الخلية وأيضا له دور رئيسي بعمليات موت الخلايا المبرمج. | |
</p> | </p> | ||
==<div style="text-align: right;"> وراثة </div> == | ==<div style="text-align: right;"> وراثة </div> == | ||
| - | + | <p dir='rtl'> | |
| - | + | جين CYCS الذي يشفر بروتين السيتوكروم C في البشر يتواجد على كروموسوم 7 في الحمض النووي DNA في نواة الخلية. هذا على عكس البروتينات الأخرى التي تعمل في عضية الميتوكوندريا المشفرة بواسطة الحمض النووي DNA للميتوكوندريا. حيث ان ال DNA للميتوكوندريا صغير جدًا، ويتألف من كروموسوم واحد صغير ويتضمن أقل من 17000 زوج قواعد نيتروجينية. بينما ال DNA في نواة الخلية يتضمن ثلاثة مليارات قاعدة نيتروجينية في 23 زوجًا من الكروموسومات. | |
| + | ومع ذلك، تحتوي كل خلية على نواة واحدة والعديد من الميتوكوندريا: في بعض الخلايا يصل عدد عضيات الميتوكوندريا إلى الآلاف، لذلك لديهم أيضًا آلاف النسخ من الحمض النووي DNA للميتوكوندريا. هناك اختلاف آخر بين أنواع الحمض النووي DNA وهو أننا نحصل على الحمض النووي DNA للميتوكوندريا من الأم فقط. تحتوي خلية الحيوانات المنوية على ميتوكوندريا، لكنها موجودة في "ذيل" الخلية، والذي يبقى بالخارج عند اتحاد الحيوان المنوي مع البويضة، يقوم الحمض النووي DNA للميتوكوندريا بتشفير13 بروتينًا ضروريًا لوظيفة الميتوكوندريا باعتبارها "محطة القوة الخلية". | ||
| + | <br> | ||
| + | يحتوي الجينوم البشري على 49 "جينا كاذبا" للجين CYCS (وهي جينات غير فعالة ولا تمر في مرحلة النسخ ولا الترجمة). للجين توجد ثلاثة اكسونات. | ||
| + | <br> | ||
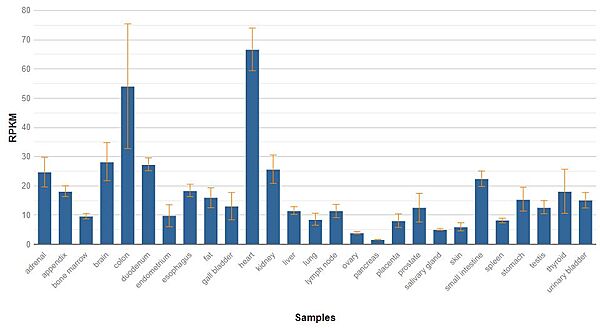
| + | يتم تركيب البروتينات من أحماض أمينية باستخدام المعلومة المشفرة في الجينات، لدى كل بروتين تسلسلٌ خاص به من الأحماض الأمينية والذي يُحدَّد بواسطة تسلسل نوكليوتيدات الجين المشفر لذلك البروتين. تُنسخ الجينات المشفرة في الدنا إلى رنا رسول والذي يُستخدم بعدها كقالب لتخليق (ترجمة) البروتين بواسطة الريبوسوم. لا يتم التعبير عن جميع الجينات في الكائن الحي في نفس الوقت حيث ان كل خلية تعبر فقط عن جزء معين من المعلومات الموجودة بها ويتم قمع الجينات الأخرى التي ليست ضرورية لوظيفة الخلية. يتم قياس التعبير الجيني للجين CYCS حسب كمية الرنا رسول في الانسجة المختلفة حيث ان التعبير يختلف من نسيج الى اخر. | ||
| + | <br> | ||
| + | <br> | ||
| + | صورة 9 | ||
| + | [[Image:Expression cytochrome c.JPG|border|center|600px|]] | ||
| + | </p> | ||
| + | <br> | ||
==<div style="text-align: right;"> أمراض </div> == | ==<div style="text-align: right;"> أمراض </div> == | ||
| - | + | <p dir='rtl'> | |
| - | + | عند الأشخاص الذين يعانون من متلازمة نقص الصفيحات وجدت طفرة في جين CYCS والتي بها يتم استبدال الحمض الاميني <scene name='89/898985/Gly__41/3'>جلايسين في المكان ال41 ( مكان محفوظ تطوريا) </scene> بالحمض الاميني سيرين . هذه المتلازمة هي متلازمة سائدة تتميز بنقص في عدد صفائح الدم وبالتالي يزداد الاحتمال لحدوث النزيف وتقل احتمالية تخثر الدم. | |
| + | لقد وجدت الدراسات الحديثة أن هذه الطفرة تزيد من النشاط المؤيد لموت الخلايا المبرمج عن طريق تنشيط الكاسبيز(caspase) بشكل أكثر كفاءة من البروتين الطبيعي. لا تؤثر هذه الطفرة على وظيفة الأكسدة والاختزال للبروتين | ||
| + | </p> | ||
==<div style="text-align: right;"> ورقة عمل للطالب </div> == | ==<div style="text-align: right;"> ورقة عمل للطالب </div> == | ||
| - | + | <p dir='rtl'> | |
| - | + | [https://proteopedia.org/wiki/images/a/a8/Homework_%28arabic%29.pdf ورقة عمل للطالب] | |
| + | <br> | ||
| + | [https://proteopedia.org/wiki/images/0/08/%D7%A0%D7%A1%D7%A4%D7%97_FASTA_%D7%A9%D7%9C_%D7%94%D7%97%D7%9C%D7%91%D7%95%D7%A0%D7%99%D7%9D.doc נספח] | ||
| + | </p> | ||
| + | <br> | ||
==<div style="text-align: right;"> المصادر </div> == | ==<div style="text-align: right;"> المصادر </div> == | ||
| + | <br> | ||
| + | [https://pubchem.ncbi.nlm.nih.gov/compound/444125#section=3D-Conformer pubchem] | ||
| + | <br> | ||
| + | [https://www.ncbi.nlm.nih.gov/protein/NP_061820.1 ncbi - cytochrome c - homo sapiens] | ||
| + | <br> | ||
| + | [https://ashpublications.org/blood/article/132/Supplement%201/3758/265249/A-Novel-Cycs-Missense-Mutation-in-the-Helix-of-the A Novel Cycs Missense Mutation in the α-Helix of the Cycs C-Terminal Domain Causes Non-Syndromic Thrombocytopenia] | ||
| + | <br> | ||
| + | [https://davidson.weizmann.ac.il/online/sciencenews/%D7%9C%D7%A8%D7%90%D7%95%D7%AA-%D7%90%D7%AA-%D7%94%D7%9E%D7%95%D7%9C%D7%A7%D7%95%D7%9C%D7%95%D7%AA-%D7%A0%D7%98%D7%A2%D7%A0%D7%95%D7%AA לראות את המולקולות נטענות - מכון דוידסון] | ||
| + | <br> | ||
| + | [https://www.ncbi.nlm.nih.gov/genome/gdv/browser/gene/?id=54205 ncbi cics gene] | ||
| + | <br> | ||
| + | [https://www.rcsb.org/structure/1gu2 pdb - 1GU2] | ||
| + | <br> | ||
| + | [https://www.rcsb.org/structure/1AKK pdb - 1AKK] | ||
| + | <br> | ||
| + | [https://chem.libretexts.org/Courses/Saint_Marys_College_Notre_Dame_IN/CHEM_342%3A_Bio-inorganic_Chemistry/Readings/Metals_in_Biological_Systems_(Saint_Mary's_College)/Cytochrome_C Cytochrome C. (2019, June 5).] | ||
| + | <br> | ||
| + | [https://www.ncbi.nlm.nih.gov/gene/54205 ncbi - CYCS cytochrome c - Homo sapiens] | ||
| + | <br> | ||
| + | [https://www.nature.com/articles/nrm2434 nature - Cytochrome c: functions beyond respiration] | ||
Current revision
سيتوكروم سي البشري
.سيتوكروم سي عبارة عن زلال صغير (الوزن الجزيئي حوالي 1200 دالتون ) وهو بروتين محفوظ للغاية عبر مجموعة من الأنواع ، موجود في النباتات والحيوانات والعديد من الكائنات أحادية الخلية يرتبط هذا البروتين بمجموعة هيم وبمركزها توجد ذرة حديد، وهو بروتين رئيسي في سلسلة نقل الالكترونات وبعملية الاستموات (موت الخلايا المبرمج)
| |||||||||||