Phenol hydroxylase (hebrew)
From Proteopedia
(Difference between revisions)
| (156 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
| - | =<center> | + | =<center>פנול הידרוקסילאז</center>= |
| - | <StructureSection load=' | + | <StructureSection load='1foh' size='340' side='left' caption='Phenol hydroxylase FAD and phenol קומפלקס עם (PDB code [[1foh]])'> |
| - | + | : <br> | |
| - | + | ==<p dir='rtl'>'''מידע כללי'''</p>== | |
| + | : <br> | ||
| + | <p dir='rtl'>מקור האנזים הינו מתאי שמר בשם cutaneotrichosporon cutaneum.</p> | ||
| + | : <br> | ||
| + | <p dir='rtl'>האנזים פנול הידרוקסילאז שייך למשפחת האנזימים פלווין (flavin enzymes), המכונים בדרך כלל הידרוקסילאזות ארומטיות. ידוע גם בשם, פנול 2-מונואוקסיגנאז. | ||
| + | פעילותו של אנזים זה נחקרת, בין היתר, כיוון שנעשה בו שימוש נרחב בתעשיה בתהליכי טיהור סביבתים ביולוגיים לפירוק וניטרול של מולקולות פנול, תרכובות אורגניות בעלות מבנה פשוט של טבעת בנזן הקשורה לקבוצת הידרוקסיל OH. האנזים פועל על מגוון רחב של מולקולות פנול ותרכובות ארומטיות אחרות, ומופק בעיקר ממיקרואורגניזמים, כולל חיידקים ופטריות. היכולת של מיקרואורגניזמים אלה לפרק מולקולות פנול הופכת אותם לכלים חשובים בתהליכי טיהור מים, כאשר מנסים להסיר מזהמים אורגניים מהסביבה ([https://www.youtube.com/watch?v=uAyVcR17COs הביורמידציה]). המקור הבלעדי של מולקולות פנול כמזהמים במים ובקרקע הוא זיהום תעשייתי או זיהום מדלקים. פנול הינו חומר שעלול לגרום לסרטן, בנוסף לכך גורם לבעיות אסתטיות, לטעם ולריח חזקים.</p> | ||
| + | : <br> | ||
| + | ==<p dir='rtl'>'''פעילות אנזימתית'''</p>== | ||
| - | == מבנה החלבון == | + | : <br> |
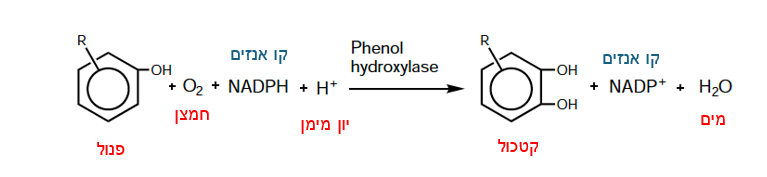
| - | <scene name='10/ | + | <p dir='rtl'>האנזים מזרז תגובת אוקסידציה, חמצון, של מולקולות פנול, בה נוספת קבוצת הידרוקסיל-OH למולקולת הפנול, ובכך ממיר אותה לקטכול (cathecol), תהליך שמהווה צעד ראשון חשוב במסלול[https://he.wikipedia.org/wiki/%D7%A4%D7%99%D7%A8%D7%95%D7%A7_%D7%91%D7%99%D7%95%D7%9C%D7%95%D7%92%D7%99_%D7%9E%D7%99%D7%A7%D7%A8%D7%95%D7%91%D7%99%D7%90%D7%9C%D7%99 הביודגרדציה] של פנולים. האנזים מבצע תגובת חימצון/חיזור עם חמצן וקו אנזים NADPH. בעזרת שתי מולקולות אלה נוצרת קבוצת הידרוקסיל המתחברת לטבעת הפנול וכך הופכת אותו לקטכול.</p> |
| + | |||
| + | : <br> | ||
| + | <p dir='rtl'> תרכובות הקטכול הנוצרות בעקבות האוקסידציה נוטות להיות פחות רעילות ממולקולת הפנול המקורית ויותר מסיסות במים, דבר המקל על הסרתן מהסביבה. בפעילות האנזים מעורב FAD, [https://milog.co.il/%D7%A7%D7%95%D7%A4%D7%A7%D7%98%D7%95%D7%A8 קו-פקטור] הדרוש לאנזים על מנת לזרז את התגובה . </p> | ||
| + | : <br> | ||
| + | <p dir='rtl'>:הראקציה הכימית המזורזת על ידי האנזים פנול הידרוקסילז מופיעה באיור מטה</p> | ||
| + | [[Image:צילום מסך 2024-03-06 222131.png|center|מהלך התגובה]] | ||
| + | : <br> | ||
| + | <p dir='rtl'>שמרים החיים בקרקע משתמשים באנזימים המכילים פלבין אדנין דינוקלאוטיד (FAD) להידרוקסילציה של מולקולות פנול. פנול הוא הסובסטרט הטוב ביותר, לפעילות הפנול הידרוקסילאז, אך האנזים מקבל גם מולקולות פנול פשוטות עם הידרוקסי-, אמינו-, הלוגן- או מתיל. | ||
| + | תגובת ההידרוקסלציה מתחילה רצף מטבולי המאפשר את השימוש בתרכובת המתקבלות כמקור פחמן ואנרגיה. מולקולות הקטכול המתקבלות מומרות בתהליכים כימיים לתרכובות אורגניות שונות כגון אצטיל-CoA המשתלבות[https://he.wikipedia.org/wiki/%D7%9E%D7%A2%D7%92%D7%9C_%D7%A7%D7%A8%D7%91%D7%A1 במעגל קרבס] </p> | ||
| + | : <br> | ||
| + | <p dir='rtl'>מעגל קרבס מהווה ביצורים אווירניים את השלב השני מתוך שלושה בתהליך הנשימה התאית. לפני המעגל מתרחשת הגליקוליזה, התוצר שלה, פירובט, הופך לאצטיל קואנזים A, שמהווה את תחילתו של מעגל קרבס. התוצרים של המעגל הם שתי מולקולות ATP ושני נושאי אלקטרונים - NADH ו-FADH2 העוברים לשלב השלישי והאחרון של ([https://www.youtube.com/watch?v=JVAVL2mADig הנשימה התאית]), בו הם תורמים את האלקטרונים שלהם לחמצן. </p> | ||
| + | : <br> | ||
| + | |||
| + | |||
| + | : <br> | ||
| + | ==<p dir='rtl'>'''גיבוש החלבון'''</p>== | ||
| + | : <br> | ||
| + | <p dir='rtl'>האנזים פנול הידרוקסילאז, המוצג בערך זה, גובש באופן מלא. בנוסף האנזים גובש יחד עם הקו-פקטור FAD ועם הסובסטרט פנול. מבנה הקריסטל שגובש מספק ראיות לשינוי מבני מתואם באנזים ובקואנזים שלו במהלך הפעילות האנזימתית. החלבון גובש כארבע יחידות. .</p> | ||
| + | : <br> | ||
| + | ==<p dir='rtl'>'''מבנה החלבון'''</p>== | ||
| + | : <br> | ||
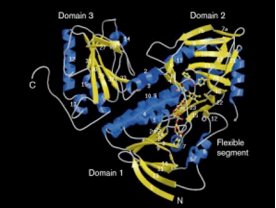
| + | <p dir='rtl'><scene name='10/1025413/The_protein/1'>החלבון השלם של פנול הידרוקסילאז</scene> מורכב משני <scene name='10/1025413/Phnol_hidroksilas_homodimer/1'>הומודימרים</scene> כל הומודימר מורכב משתי תתי יחידות זהות, כל תת יחידה מכילה 665 חומצות אמינו. המבנה [https://he.wikibooks.org/wiki/%D7%91%D7%99%D7%95%D7%9B%D7%99%D7%9E%D7%99%D7%94/%D7%9E%D7%91%D7%A0%D7%94_%D7%97%D7%9C%D7%91%D7%95%D7%9F השניוני] של החלבון מכיל <scene name='10/1025413/Alpha_helix_and_beta_sheets_1/1'>מבני משטחי בטא גדולים ומבני אלפא הליקס.</scene> </p> | ||
| + | : <br> | ||
| + | <p dir='rtl'>תת-היחידה של פנול הידרוקסילאז מורכבת משלושה מתחמים. שני המתחמים הראשונים מהווים את האתר הפעיל וקושרים את הקו-פקטור ,<scene name='10/1025413/Fad_1/1'>FAD</scene> ואת <scene name='10/1025413/Fnol_1/1'>הסובסטראט- הפנול</scene>, בעוד המתחם הנוסף (השלישי) בעל תפקיד לא ידוע. </p> | ||
| + | : <br> | ||
| + | [[Image:צילום מסך 2024-03-06 224352.png|center|מתחמים של תת היחידה]] | ||
| + | : <br> | ||
| + | <p dir='rtl'>מיקום האתרים הפעילים לקישור פנול: ח.אמינו 55, 290 | ||
| + | מיקום האתרים הפעילים לקישור FAD: ח. אמינו 18-19, 43-45, 51-56, 118, 290,358, 368-376 | ||
| + | </p> | ||
| + | <p dir='rtl'> בנוסף, ניתן לראות במבנה החלבון<scene name='10/1025417/Hydrophobic_and_hydrophilic/2'> אזורים הידרופוביים באדום ואזורים הידרופיליים בכחול.</scene></p> | ||
| + | : <br> | ||
| + | <p dir='rtl'>מניתוח מבנה החלבון נמצא כי לאחר קישור הקו-פקטור FAD, חל שינוי משמעותי במבנה החלבון בלולאה הקרובה לאתר הפעיל , ממצב ״פתוח״ למצב ״סגור״. שינוי מבני זה גורם לחשיפת האתר הפעיל ומאפשר גישה לשלושת הסובסטרטים - פנול, NADPH וחמצן, ולחסימת האתר כלפי הממס ובכך מתאפשרת תגובת ההידרוקסילציה. | ||
| + | </p> | ||
| + | : <br> | ||
| + | ==<p dir='rtl'>'''מקורות מידע'''</p>== | ||
| + | Enroth, C., Neujahr, H., Schneider, G., & Lindqvist, Y. (1998). The crystal structure of phenol hydroxylase in complex with FAD and phenol provides evidence for a concerted conformational change in the enzyme and its cofactor during catalysis. Structure, 6(5), 605-617. | ||
| + | : <br> | ||
| + | ==<p dir='rtl'>'''שאלות'''</p>== | ||
| + | |||
| + | <div style="text-align: right; direction: rtl; margin-left: 1em;"> | ||
| + | |||
| + | |||
| + | <quiz display=simple> | ||
| + | { בכל שאלה בחרו בתשובה הנכונה. | ||
| + | נתון כי מבנה החלבון הינו שני הומודימרים. מה ניתן ללמוד ממידע זה? | ||
| + | |type="()"} | ||
| + | - החלבון מורכב משתי תתי-יחידות שונות. | ||
| + | + החלבון מורכב משתי תתי-יחידות זהות, כל אחת מהן מורכבת משתי שרשראות זהות. | ||
| + | - החלבון מורכב משתי תתי-יחידות זהות, כל אחת מהן מורכבת משתי שרשראות שונות. | ||
| + | - החלבון מורכב מארבע שרשראות שונות. | ||
| + | |||
| + | |||
| + | {האנזים מזרז תגובה של: | ||
| + | |type="()"} | ||
| + | - אוקסידציה של קטכול. | ||
| + | + אוקסידציה של פנול. | ||
| + | - אוקסידציה של הידרוקסיל. | ||
| + | - אוקסידציה של קופקטור FAD. | ||
| + | |||
| + | {התבוננו בסצנה המציגה את הסובסטרט- מולקולת הפנול, כמה אתרי קישור יש למולקולת הפנול בחלבון השלם? | ||
| + | |type="()"} | ||
| + | -1 | ||
| + | -2 | ||
| + | -3 | ||
| + | +4 | ||
| + | |||
| + | {אילו שימושים נעשים בתעשייה באנזים פנול הידרוקסילאז? | ||
| + | |type="()"} | ||
| + | - יצירת פנולים המשמשים כדלקים בתעשיה. | ||
| + | - זירוז הבשלת פירות. | ||
| + | + פירוק מזהמים סביבתיים על בסיס פנול. | ||
| + | - זירוז פירוק מזהמים סביבתיים על בסיס מתכות. | ||
| + | </quizz> | ||
| + | |||
| + | |||
| + | ===<>=== | ||
| - | == Relevance == | ||
| - | == Structural highlights == | ||
| - | This is a sample scene created with SAT to <scene name="/12/3456/Sample/1">color</scene> by Group, and another to make <scene name="/12/3456/Sample/2">a transparent representation</scene> of the protein. You can make your own scenes on SAT starting from scratch or loading and editing one of these sample scenes. | ||
</StructureSection> | </StructureSection> | ||
| - | == References == | ||
<references/> | <references/> | ||
Current revision
פנול הידרוקסילאז
| |||||||||||
Proteopedia Page Contributors and Editors (what is this?)
Nurit Ben Shimol, Rivka Cohen, Jonathan Guez, Michal Harel, Offir Lupo