Phenol hydroxylase (hebrew)
From Proteopedia
(Difference between revisions)
| (9 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
=<center>פנול הידרוקסילאז</center>= | =<center>פנול הידרוקסילאז</center>= | ||
| - | <StructureSection load=' | + | <StructureSection load='1foh' size='340' side='left' caption='Phenol hydroxylase FAD and phenol קומפלקס עם (PDB code [[1foh]])'> |
: <br> | : <br> | ||
==<p dir='rtl'>'''מידע כללי'''</p>== | ==<p dir='rtl'>'''מידע כללי'''</p>== | ||
| Line 12: | Line 12: | ||
: <br> | : <br> | ||
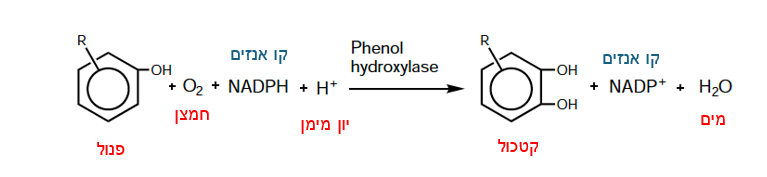
| - | <p dir='rtl'>האנזים מזרז תגובת אוקסידציה, חמצון, של | + | <p dir='rtl'>האנזים מזרז תגובת אוקסידציה, חמצון, של מולקולות פנול, בה נוספת קבוצת הידרוקסיל-OH למולקולת הפנול, ובכך ממיר אותה לקטכול (cathecol), תהליך שמהווה צעד ראשון חשוב במסלול[https://he.wikipedia.org/wiki/%D7%A4%D7%99%D7%A8%D7%95%D7%A7_%D7%91%D7%99%D7%95%D7%9C%D7%95%D7%92%D7%99_%D7%9E%D7%99%D7%A7%D7%A8%D7%95%D7%91%D7%99%D7%90%D7%9C%D7%99 הביודגרדציה] של פנולים. האנזים מבצע תגובת חימצון/חיזור עם חמצן וקו אנזים NADPH. בעזרת שתי מולקולות אלה נוצרת קבוצת הידרוקסיל המתחברת לטבעת הפנול וכך הופכת אותו לקטכול.</p> |
: <br> | : <br> | ||
| - | <p dir='rtl'> תרכובות הקטכול הנוצרות בעקבות האוקסידציה נוטות להיות פחות רעילות ממולקולת הפנול המקורית ויותר מסיסות במים, דבר המקל על הסרתן מהסביבה. בפעילות האנזים מעורב FAD, קו-פקטור הדרוש לאנזים על מנת לזרז את התגובה . </p> | + | <p dir='rtl'> תרכובות הקטכול הנוצרות בעקבות האוקסידציה נוטות להיות פחות רעילות ממולקולת הפנול המקורית ויותר מסיסות במים, דבר המקל על הסרתן מהסביבה. בפעילות האנזים מעורב FAD, [https://milog.co.il/%D7%A7%D7%95%D7%A4%D7%A7%D7%98%D7%95%D7%A8 קו-פקטור] הדרוש לאנזים על מנת לזרז את התגובה . </p> |
: <br> | : <br> | ||
<p dir='rtl'>:הראקציה הכימית המזורזת על ידי האנזים פנול הידרוקסילז מופיעה באיור מטה</p> | <p dir='rtl'>:הראקציה הכימית המזורזת על ידי האנזים פנול הידרוקסילז מופיעה באיור מטה</p> | ||
| Line 36: | Line 36: | ||
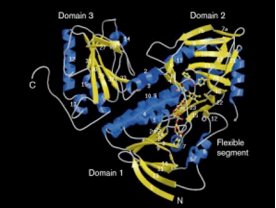
<p dir='rtl'><scene name='10/1025413/The_protein/1'>החלבון השלם של פנול הידרוקסילאז</scene> מורכב משני <scene name='10/1025413/Phnol_hidroksilas_homodimer/1'>הומודימרים</scene> כל הומודימר מורכב משתי תתי יחידות זהות, כל תת יחידה מכילה 665 חומצות אמינו. המבנה [https://he.wikibooks.org/wiki/%D7%91%D7%99%D7%95%D7%9B%D7%99%D7%9E%D7%99%D7%94/%D7%9E%D7%91%D7%A0%D7%94_%D7%97%D7%9C%D7%91%D7%95%D7%9F השניוני] של החלבון מכיל <scene name='10/1025413/Alpha_helix_and_beta_sheets_1/1'>מבני משטחי בטא גדולים ומבני אלפא הליקס.</scene> </p> | <p dir='rtl'><scene name='10/1025413/The_protein/1'>החלבון השלם של פנול הידרוקסילאז</scene> מורכב משני <scene name='10/1025413/Phnol_hidroksilas_homodimer/1'>הומודימרים</scene> כל הומודימר מורכב משתי תתי יחידות זהות, כל תת יחידה מכילה 665 חומצות אמינו. המבנה [https://he.wikibooks.org/wiki/%D7%91%D7%99%D7%95%D7%9B%D7%99%D7%9E%D7%99%D7%94/%D7%9E%D7%91%D7%A0%D7%94_%D7%97%D7%9C%D7%91%D7%95%D7%9F השניוני] של החלבון מכיל <scene name='10/1025413/Alpha_helix_and_beta_sheets_1/1'>מבני משטחי בטא גדולים ומבני אלפא הליקס.</scene> </p> | ||
: <br> | : <br> | ||
| - | <p dir='rtl'>תת-היחידה של פנול הידרוקסילאז מורכבת משלושה מתחמים. שני | + | <p dir='rtl'>תת-היחידה של פנול הידרוקסילאז מורכבת משלושה מתחמים. שני המתחמים הראשונים מהווים את האתר הפעיל וקושרים את הקו-פקטור ,<scene name='10/1025413/Fad_1/1'>FAD</scene> ואת <scene name='10/1025413/Fnol_1/1'>הסובסטראט- הפנול</scene>, בעוד המתחם הנוסף (השלישי) בעל תפקיד לא ידוע. </p> |
: <br> | : <br> | ||
[[Image:צילום מסך 2024-03-06 224352.png|center|מתחמים של תת היחידה]] | [[Image:צילום מסך 2024-03-06 224352.png|center|מתחמים של תת היחידה]] | ||
| Line 43: | Line 43: | ||
מיקום האתרים הפעילים לקישור FAD: ח. אמינו 18-19, 43-45, 51-56, 118, 290,358, 368-376 | מיקום האתרים הפעילים לקישור FAD: ח. אמינו 18-19, 43-45, 51-56, 118, 290,358, 368-376 | ||
</p> | </p> | ||
| - | <p dir='rtl'><scene name='10/1025417/Hydrophobic_and_hydrophilic/2'> | + | <p dir='rtl'> בנוסף, ניתן לראות במבנה החלבון<scene name='10/1025417/Hydrophobic_and_hydrophilic/2'> אזורים הידרופוביים באדום ואזורים הידרופיליים בכחול.</scene></p> |
: <br> | : <br> | ||
<p dir='rtl'>מניתוח מבנה החלבון נמצא כי לאחר קישור הקו-פקטור FAD, חל שינוי משמעותי במבנה החלבון בלולאה הקרובה לאתר הפעיל , ממצב ״פתוח״ למצב ״סגור״. שינוי מבני זה גורם לחשיפת האתר הפעיל ומאפשר גישה לשלושת הסובסטרטים - פנול, NADPH וחמצן, ולחסימת האתר כלפי הממס ובכך מתאפשרת תגובת ההידרוקסילציה. | <p dir='rtl'>מניתוח מבנה החלבון נמצא כי לאחר קישור הקו-פקטור FAD, חל שינוי משמעותי במבנה החלבון בלולאה הקרובה לאתר הפעיל , ממצב ״פתוח״ למצב ״סגור״. שינוי מבני זה גורם לחשיפת האתר הפעיל ומאפשר גישה לשלושת הסובסטרטים - פנול, NADPH וחמצן, ולחסימת האתר כלפי הממס ובכך מתאפשרת תגובת ההידרוקסילציה. | ||
| Line 73: | Line 73: | ||
- אוקסידציה של קופקטור FAD. | - אוקסידציה של קופקטור FAD. | ||
| + | {התבוננו בסצנה המציגה את הסובסטרט- מולקולת הפנול, כמה אתרי קישור יש למולקולת הפנול בחלבון השלם? | ||
| + | |type="()"} | ||
| + | -1 | ||
| + | -2 | ||
| + | -3 | ||
| + | +4 | ||
{אילו שימושים נעשים בתעשייה באנזים פנול הידרוקסילאז? | {אילו שימושים נעשים בתעשייה באנזים פנול הידרוקסילאז? | ||
Current revision
פנול הידרוקסילאז
| |||||||||||
Proteopedia Page Contributors and Editors (what is this?)
Nurit Ben Shimol, Rivka Cohen, Jonathan Guez, Michal Harel, Offir Lupo