User:Clara Fernández Vidal/Isocitrato deshidrogenasa
From Proteopedia
| (20 intermediate revisions not shown.) | |||
| Line 19: | Line 19: | ||
La IDH es una importante enzima en el metabolismo celular humano formando parte del ciclo de Krebs, catalizando la descarboxilación oxidativa del isocitrato (ICT) en α-cetoglutarato (αKG). Las células humanas expresan al menos tres IDH diferentes: IDH1, IDH2 e IDH3. | La IDH es una importante enzima en el metabolismo celular humano formando parte del ciclo de Krebs, catalizando la descarboxilación oxidativa del isocitrato (ICT) en α-cetoglutarato (αKG). Las células humanas expresan al menos tres IDH diferentes: IDH1, IDH2 e IDH3. | ||
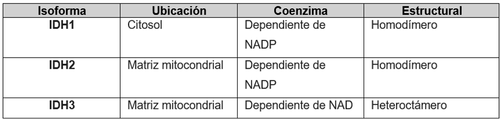
| - | La IDH1 es dependiente de NADP y está ubicada en el citosol, la IDH2 se ubica en la matriz mitocondrial y es dependiente de NADP, es muy parecida estructuralmente a la IDH1 y, por último, la IDH3 utiliza NAD como cofactor en la matriz mitocondrial.<ref | + | La IDH1 es dependiente de NADP y está ubicada en el citosol, la IDH2 se ubica en la matriz mitocondrial y es dependiente de NADP, es muy parecida estructuralmente a la IDH1 y, por último, la IDH3 utiliza NAD como cofactor en la matriz mitocondrial.<ref>Yang B, Zhong C, Peng Y, Lai Z, Ding J. Molecular mechanisms of "off-on switch" of activities of human IDH1 by tumor-associated mutation R132H. Cell Res. 2010 Nov;20(11):1188-200. doi: 10.1038/cr.2010.145. Epub 2010 Oct 26. PMID: 20975740.</ref> <ref name="ref2">Xu X, Zhao J, Xu Z, Peng B, Huang Q, Arnold E, Ding J. Structures of human cytosolic NADP-dependent isocitrate dehydrogenase reveal a novel self-regulatory mechanism of activity. J Biol Chem. 2004 Aug 6;279(32):33946-57. doi: 10.1074/jbc.M404298200. Epub 2004 Jun 1. PMID: 15173171.</ref> <ref>Chen X, Yang P, Qiao Y, Ye F, Wang Z, Xu M, Han X, Song L, Wu Y, Ou WB. Effects of cancer-associated point mutations on the structure, function, and stability of isocitrate dehydrogenase 2. Sci Rep. 2022 Nov 5;12(1):18830. doi: 10.1038/s41598-022-23659-y. PMID: 36335201; PMCID: PMC9637083.</ref>. Véase a continuación la '''Tabla 2''' que resume lo descrito. |
| Line 32: | Line 32: | ||
<StructureSection load='' size='350' side='right' caption='' scene=''> | <StructureSection load='' size='350' side='right' caption='' scene=''> | ||
| + | __NOTOC__ | ||
==Estructura de la IDH1 y sitio activo== | ==Estructura de la IDH1 y sitio activo== | ||
| Line 61: | Line 62: | ||
</jmol> | </jmol> | ||
| - | La conformación de la subunidad A (rojo) en el complejo binario (IDH-NADP) se parece más a la forma abierta. ''Xiang Xu et al'' | + | La conformación de la subunidad A (rojo) en el complejo binario (IDH-NADP) se parece más a la forma abierta. ''Xiang Xu et al'' <ref name="ref2"/> proponen que la conformación abierta de IDH puede corresponder a la forma inactiva de la enzima. |
La conformación de IDH de la subunidad B (azul) del complejo binario (IDH-NADP) está entre la forma abierta y la cerrada. Proponen que la forma semiabierta de la IDH puede representar una forma intermedia entre la conformación activa y la inactiva. | La conformación de IDH de la subunidad B (azul) del complejo binario (IDH-NADP) está entre la forma abierta y la cerrada. Proponen que la forma semiabierta de la IDH puede representar una forma intermedia entre la conformación activa y la inactiva. | ||
===Conservación evolutiva=== | ===Conservación evolutiva=== | ||
| - | Se procedió al estudio de la conservación evolutiva de la isocitrato deshidrogenasa. | + | Se procedió al estudio de la conservación evolutiva de la isocitrato deshidrogenasa. Se representó: |
| - | + | *la enzima dimérica con código PDB 1T09, con el ligando NADP en verde brillante | |
| + | *la cadena A de la enzima con código PDB 1T09, coloreada según su conservación evolutiva y el ligando NADP en verde brillante. | ||
<scene name='10/1037483/Conservacion_dimero_1t09/4'>Pulsar para ver conservación evolutiva</scene> | <scene name='10/1037483/Conservacion_cadenaa_1t09/2'>Conservación cadena A</scene> | <scene name='10/1037483/Conservacion_dimero_1t09/4'>Pulsar para ver conservación evolutiva</scene> | <scene name='10/1037483/Conservacion_cadenaa_1t09/2'>Conservación cadena A</scene> | ||
| Line 84: | Line 86: | ||
<jmolLink> | <jmolLink> | ||
<text> Pulsar para activar la imagen </text> | <text> Pulsar para activar la imagen </text> | ||
| - | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/3/3e/ESCENA_2.png";color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n abierta";set echo m2 model 2.1; echo "Conformaci\u00F3n | + | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/3/3e/ESCENA_2.png";color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n abierta";set echo m2 model 2.1; echo "Conformaci\u00F3n semiabierta";</script> |
</jmolLink> | </jmolLink> | ||
</jmol> | <jmol> | </jmol> | <jmol> | ||
| Line 90: | Line 92: | ||
<text> Cadena A, conformación abierta </text> | <text> Cadena A, conformación abierta </text> | ||
<script>anim off; frame 1;</script> | <script>anim off; frame 1;</script> | ||
| - | </jmolLink> | <jmolLink> | + | </jmolLink> </jmol> | <jmol> <jmolLink> |
| - | <text> Cadena B, conformación | + | <text> Cadena B, conformación semiabierta</text> |
<script>anim off; frame 2;</script> | <script>anim off; frame 2;</script> | ||
| - | </jmolLink> | <jmolLink> | + | </jmolLink> </jmol> | <jmol> <jmolLink> |
<text> Animación </text> | <text> Animación </text> | ||
<script>anim mode palindrome; frame play;</script> | <script>anim mode palindrome; frame play;</script> | ||
| Line 107: | Line 109: | ||
La conformación inactiva es la cadena A de la 1T09 (complejo binario); la conformación activa es la cadena A de la 1T0L (complejo cuaternario)con ICT en blanco y Ca2+ en cian. NADP amarillo y péptido regulatorio en naranja en ambas conformaciones. Los colores de los dominios se mantienen de acuerdo con las anteriores escenas. | La conformación inactiva es la cadena A de la 1T09 (complejo binario); la conformación activa es la cadena A de la 1T0L (complejo cuaternario)con ICT en blanco y Ca2+ en cian. NADP amarillo y péptido regulatorio en naranja en ambas conformaciones. Los colores de los dominios se mantienen de acuerdo con las anteriores escenas. | ||
| - | Además, el modelo de trabajo de ''Xiang Xu et al'' | + | Además, el modelo de trabajo de ''Xiang Xu et al''<ref name="ref2"/> postula que la IDH puede utilizar el segmento regulatorio y las interacciones de Asp279 (morado) con Ser94 (verde pistacho) para inactivar la enzima, lo cual se comprueba con la escena 3D puesto que se observó que al entrar ICT y Ca2+, la proteína reguladora cambia de conformación al igual que lo hacen Asp279 y Ser94. <ref name="ref2"/> |
La unión competitiva del isocitrato induce el replegamiento de la proteína reguladora y los cambios conformacionales generales y consecuentemente para activar la enzima. | La unión competitiva del isocitrato induce el replegamiento de la proteína reguladora y los cambios conformacionales generales y consecuentemente para activar la enzima. | ||
| Line 116: | Line 118: | ||
<script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/a/a7/Escena_3_con_ligandos_y_dominios.png";color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n inactiva";set echo m2 model 2.1; echo "Conformaci\u00F3n activa";</script> | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/a/a7/Escena_3_con_ligandos_y_dominios.png";color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n inactiva";set echo m2 model 2.1; echo "Conformaci\u00F3n activa";</script> | ||
</jmolLink> | </jmolLink> | ||
| - | </jmol> | + | </jmol> | <jmol> |
| - | + | ||
| - | <jmol> | + | |
<jmolLink> | <jmolLink> | ||
<text> Conformación inactiva </text> | <text> Conformación inactiva </text> | ||
<script>anim off; frame 1;</script> | <script>anim off; frame 1;</script> | ||
| - | </jmolLink> | + | </jmolLink> </jmol> |<jmol> <jmolLink> |
| - | <jmolLink> | + | |
<text> Conformación activa </text> | <text> Conformación activa </text> | ||
<script>anim off; frame 2;</script> | <script>anim off; frame 2;</script> | ||
| - | </jmolLink> | + | </jmolLink> </jmol> | <jmol> <jmolLink> |
| - | + | ||
| - | <jmolLink> | + | |
<text> Animación </text> | <text> Animación </text> | ||
<script>anim mode palindrome; frame play;</script> | <script>anim mode palindrome; frame play;</script> | ||
| - | </jmolLink> | + | </jmolLink> </jmol> |
| - | </jmol> | + | |
'''3. Alineamiento 1T09 con 1T0L, cadenas A''' | '''3. Alineamiento 1T09 con 1T0L, cadenas A''' | ||
| Line 143: | Line 139: | ||
<jmolLink> | <jmolLink> | ||
<text> Pulsar para activar la imagen </text> | <text> Pulsar para activar la imagen </text> | ||
| - | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/9/9b/Alineamiento_con_colores_por_dominios.png";color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n | + | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/9/9b/Alineamiento_con_colores_por_dominios.png";color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n activa";set echo m2 model 2.1; echo "Conformaci\u00F3n inactiva";</script> |
</jmolLink> | </jmolLink> | ||
| - | </jmol> | + | </jmol> | <jmol> <jmolLink> |
| - | + | ||
| - | <jmol> | + | |
| - | + | ||
<text> Conformación inactiva </text> | <text> Conformación inactiva </text> | ||
<script>anim off; frame 2;</script> | <script>anim off; frame 2;</script> | ||
| - | </jmolLink> | + | </jmolLink> | <jmol> <jmolLink> |
| - | <jmolLink> | + | |
<text> Conformación activa </text> | <text> Conformación activa </text> | ||
<script>anim off; frame 1;</script> | <script>anim off; frame 1;</script> | ||
| - | </jmolLink> | + | </jmolLink> </jmol> | <jmol> <jmolLink> |
| - | + | ||
| - | <jmolLink> | + | |
<text> Animación </text> | <text> Animación </text> | ||
<script>anim mode palindrome; frame play;</script> | <script>anim mode palindrome; frame play;</script> | ||
| - | </jmolLink> | + | </jmolLink></jmol> |
| - | </jmol> | + | |
'''4. Interacción Arg132 con ICT''' | '''4. Interacción Arg132 con ICT''' | ||
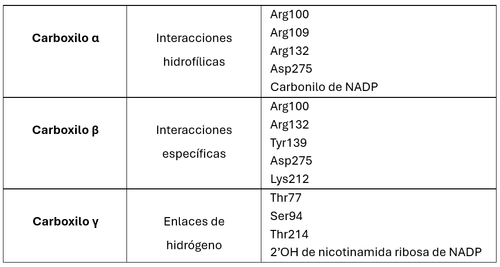
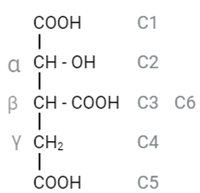
| - | Se quiso demostrar la interacción entre el ligando ICT y la Arg132; con el siguiente comando: ''contact {ICT} full connect'' se buscaron los contactos del ICT en Jmol, y como se esperaba, aparecieron los 15 contactos que se describieron ''Xiang Xu et al''.<ref name="ref2" /> | + | Se quiso demostrar la interacción entre el ligando ICT y la Arg132; con el siguiente comando: ''contact {ICT} full connect'' se buscaron los contactos del ICT (blanco) en Jmol, y como se esperaba, aparecieron los 15 contactos que se describieron ''Xiang Xu et al'' <ref name="ref2"/>. Se utilizó para las dos escenas siguientes la molécula en PDB 1T0L. <ref name="ref2" /> |
*Thr77, Ser94, Arg100, Arg109, Arg132, Tyr139, y Asp275 en una subunidad | *Thr77, Ser94, Arg100, Arg109, Arg132, Tyr139, y Asp275 en una subunidad | ||
*Lys212, Thr214, y Asp252 en la subunidad adyacente | *Lys212, Thr214, y Asp252 en la subunidad adyacente | ||
*3 moléculas de agua, NADP y Ca2+ | *3 moléculas de agua, NADP y Ca2+ | ||
| - | |||
<jmol> | <jmol> | ||
<jmolLink> | <jmolLink> | ||
| - | <text>Pulsar para ver el contacto Arg132-ICT | + | <text>Pulsar para ver los 15 contactos de ICT</text> |
| - | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/f/f0/Escena6_nueva_contacto_ICT_con_Arg132.png";zoom 404;</script> | + | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/c/c0/15_contactos.png |
| - | </jmolLink> | + | ";zoom 404;set echo 50% 100%; echo "Contactos de ICT";color echo cyan; font echo 18 bold sans</script> |
| - | </jmol> | + | </jmolLink> </jmol> | <jmol> <jmolLink> |
| + | <text>Pulsar para ver el contacto Arg132-ICT</text> | ||
| + | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/f/f0/Escena6_nueva_contacto_ICT_con_Arg132.png";zoom 404;set echo 50% 100%; echo "Contacto Arg132-ICT";color echo cyan; font echo 18 bold sans</script> | ||
| + | </jmolLink> </jmol> | ||
| Line 210: | Line 201: | ||
<jmol> | <jmol> | ||
<jmolLink> | <jmolLink> | ||
| - | <text> Pulsar para | + | <text> Pulsar para activar imagen </text> |
| - | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/1/15/Alineamiento_escena_mutacion.png";</script> | + | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/1/15/Alineamiento_escena_mutacion.png";color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n con mutaci\u00F3n";set echo m2 model 2.1; echo "Conformaci\u00F3n sin mutaci\u00F3n";</script> |
</jmolLink> | </jmolLink> | ||
</jmol> | </jmol> | ||
| Line 228: | Line 219: | ||
</jmolLink> | </jmolLink> | ||
</jmol> | </jmol> | ||
| - | |||
<jmol> | <jmol> | ||
<jmolLink> | <jmolLink> | ||
| Line 239: | Line 229: | ||
</table> | </table> | ||
| + | |||
| + | <table> | ||
| + | <tr> | ||
| + | <td> | ||
| + | Arg132 (rojo en 1T0L) e His (morado en 3MAS). ICT en blanco. Se observó lo que más tarde se comprobó, ICT no hace contacto con His y sí con Arg132. | ||
| + | |||
| + | Con el codigo: ''contact {ICT} {Arg132} full connect'', se exploraron los contactos entre el ligando ICT y la Arg132. La escena representa el contacto entre ICT (blanco) y Arg132 (rojo). Se mantuvo el código de colores del resto de la molécula. | ||
| + | </td> | ||
| + | <td> | ||
<jmol> | <jmol> | ||
<jmolLink> | <jmolLink> | ||
| - | <text> Pulsar para | + | <text> Pulsar para activar imagen </text> |
| - | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/b/b9/Contacto_ICT_con_Arg132_varillas_mas_gruesas.png";zoom 404;</script> | + | <script>zap;set echo 50% 50%; echo "loading...";refresh;load "/wiki/images/b/b9/Contacto_ICT_con_Arg132_varillas_mas_gruesas.png";zoom 404;color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n mutada";set echo m2 model 2.1; echo "Conformaci\u00F3n no mutada";</script> |
</jmolLink> | </jmolLink> | ||
</jmol> | </jmol> | ||
| Line 255: | Line 254: | ||
<script>anim off; frame 1;</script> | <script>anim off; frame 1;</script> | ||
</jmolLink> | </jmolLink> | ||
| - | |||
<jmolLink> | <jmolLink> | ||
<text> Animación </text> | <text> Animación </text> | ||
| Line 261: | Line 259: | ||
</jmolLink> | </jmolLink> | ||
</jmol> | </jmol> | ||
| + | </td> | ||
| + | </tr> | ||
| + | </table> | ||
| - | Arg132 (rojo en 1T0L) e His (morado en 3MAS). ICT en blanco. Se observó lo que más tarde se comprobó, ICT no hace contacto con His y sí con Arg132. | ||
| - | |||
| - | Con el codigo: ''contact {ICT} {Arg132} full connect'', se exploraron los contactos entre el ligando ICT y la Arg132. La escena representa el contacto entre ICT (blanco) y Arg132 (rojo). Se mantuvo el código de colores del resto de la molécula. | ||
| + | <table> | ||
| + | <tr> | ||
| + | <td> | ||
| + | Se puede ver en la conformación mutada que están muy lejos ICT (blanco) e His132 (morado) como para hacer contacto. Al evaluar si existe contacto entre ICT e His132, con el siguiente código: ''contact {ICT} {His132} full connect'', como era de esperar, aparecen 0 resultados. También se puede observar de nuevo en ambas imágenes el cambio conformacional que sufre el péptido regulador (naranja). | ||
| + | </td> | ||
| + | <td> | ||
<jmol> | <jmol> | ||
<jmolLink> | <jmolLink> | ||
| - | <text> Pulsar para | + | <text> Pulsar para activar imagen </text> |
<script>zap;set echo 50% 50%; echo "loading...";refresh;load " | <script>zap;set echo 50% 50%; echo "loading...";refresh;load " | ||
/wiki/images/9/93/Escena_6.3._ligands_and_contacts.png | /wiki/images/9/93/Escena_6.3._ligands_and_contacts.png | ||
| - | ";</script> | + | ";color echo cyan; font echo 18 bold sans; set echo m1 50% 100%; set echo m2 50% 100%; set echo m1 model 1.1; echo "Conformaci\u00F3n mutada";set echo m2 model 2.1; echo "Conformaci\u00F3n normal";</script> |
</jmolLink> | </jmolLink> | ||
</jmol> | </jmol> | ||
| Line 284: | Line 288: | ||
<script>anim off; frame 1;</script> | <script>anim off; frame 1;</script> | ||
</jmolLink> | </jmolLink> | ||
| - | |||
<jmolLink> | <jmolLink> | ||
<text> Animación </text> | <text> Animación </text> | ||
| Line 290: | Line 293: | ||
</jmolLink> | </jmolLink> | ||
</jmol> | </jmol> | ||
| + | </td> | ||
| + | </tr> | ||
| + | </table> | ||
| - | Se puede ver en la conformación mutada que están muy lejos ICT (blanco) e His132 (morado) como para hacer contacto. Al evaluar si existe contacto entre ICT e His132, con el siguiente código: ''contact {ICT} {His132} full connect'', como era de esperar, aparecen 0 resultados. También se puede observar de nuevo en ambas imágenes el cambio conformacional que sufre el péptido regulador (naranja). | ||
Siguiendo con el estudio de los contactos y empleando esta línea de código en Jmol: ''contact {ICT} full connect'', para estudiar todos los contactos de ICT, se observa que aparecen 27 contactos; hay contactos nuevos con la mutación comparando con los que existían antes sin la mutación de Arg132 (15 contactos). | Siguiendo con el estudio de los contactos y empleando esta línea de código en Jmol: ''contact {ICT} full connect'', para estudiar todos los contactos de ICT, se observa que aparecen 27 contactos; hay contactos nuevos con la mutación comparando con los que existían antes sin la mutación de Arg132 (15 contactos). | ||
Current revision
Contents |
Isocitrato deshidrogenasa: escenas 3D para la comprensión de su función y estructura
El objetivo de la publicación de este artículo fue enriquecer con escenas 3D la bibliografía existente sobre la conocida enzima isocitrato deshidrogenasa (IDH) de manera que se pudieran observar mejor las interacciones de los ligandos con la enzima, así como entender los cambios conformacionales que causan las mutaciones en los centros activos de esta. En otras palabras, se demostró con la visualización 3D una mejora en el estudio de estructura y función de biomoléculas.
Criterios de búsqueda en Protein Data Bank (PDB)
Se procedió a estudiar la Isocitrato deshidrogenasa (IDH) a partir de bibliografía existente. Primeramente, se hizo una búsqueda en PDB [1] con el término de isocitrate dehydrogenase y se filtró para seleccionar solo aquellas enzimas que fueran pertenecientes a Homo sapiens; aparecieron 16 resultados que son los que se recogen en la Tabla 1.
Tabla 1. Listado de resultados basados en la búsqueda de isocitrate dehydrogenase en PDB filtrando por Homo sapiens. Las estructuras sombreadas son las utilizadas en este estudio.
Los códigos de PDB de las enzimas con las que se trabajó fueron: 1T09,1T0L y 3MAS por la accesibilidad a la bibliografía y el interés de su contenido.
La enzima y sus isoformas
La IDH es una importante enzima en el metabolismo celular humano formando parte del ciclo de Krebs, catalizando la descarboxilación oxidativa del isocitrato (ICT) en α-cetoglutarato (αKG). Las células humanas expresan al menos tres IDH diferentes: IDH1, IDH2 e IDH3.
La IDH1 es dependiente de NADP y está ubicada en el citosol, la IDH2 se ubica en la matriz mitocondrial y es dependiente de NADP, es muy parecida estructuralmente a la IDH1 y, por último, la IDH3 utiliza NAD como cofactor en la matriz mitocondrial.[2] [3] [4]. Véase a continuación la Tabla 2 que resume lo descrito.
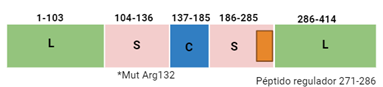
Este estudio se centró en la isoforma IDH1 debido a que su estructura dimérica era más simple, existía información acerca de las mutaciones que sufre y por ello encajó mejor con el objetivo de añadir escenas 3D que permitieran enriquecer los artículos consultados.
| |||||||||||
Distintas conformaciones pueden representar diferentes estados enzimáticos
Los dos complejos (binario y cuaternario) presentan tres conformaciones diferentes. La conformación general del complejo cuaternario se parece a la cerrada. La zona activa puede adoptar una conformación compacta o cerrada. En la evidencia, sugirieron que las diferencias conformacionales de los segmentos regulatorios en los tres conformadores de IDH estaban probablemente relacionadas con las funciones biológicas de la enzima y que las distintas conformaciones de IDH observadas en las dos estructuras complejas eran biológicamente relevantes, pudiendo representar diferentes estados enzimáticos.[3]
Conclusión
Se muestra en este trabajo la gran utilidad de las representaciones en 3D para biomoléculas complejas en publicaciones científicas. La visualización en 3D permite acercarse a las estructuras para así entender mejor su composición y función, así como las uniones con sus ligandos y sus cambios conformacionales; cosas que en formato 2D, el único posible en imágenes de publicaciones tradicionales, a menudo se escapan.
References
- ↑ Protein Data Bank in Europe (PDBe). (n.d.). Recuperado de: https://www.ebi.ac.uk/pdbe/
- ↑ Yang B, Zhong C, Peng Y, Lai Z, Ding J. Molecular mechanisms of "off-on switch" of activities of human IDH1 by tumor-associated mutation R132H. Cell Res. 2010 Nov;20(11):1188-200. doi: 10.1038/cr.2010.145. Epub 2010 Oct 26. PMID: 20975740.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 3.7 3.8 Xu X, Zhao J, Xu Z, Peng B, Huang Q, Arnold E, Ding J. Structures of human cytosolic NADP-dependent isocitrate dehydrogenase reveal a novel self-regulatory mechanism of activity. J Biol Chem. 2004 Aug 6;279(32):33946-57. doi: 10.1074/jbc.M404298200. Epub 2004 Jun 1. PMID: 15173171.
- ↑ Chen X, Yang P, Qiao Y, Ye F, Wang Z, Xu M, Han X, Song L, Wu Y, Ou WB. Effects of cancer-associated point mutations on the structure, function, and stability of isocitrate dehydrogenase 2. Sci Rep. 2022 Nov 5;12(1):18830. doi: 10.1038/s41598-022-23659-y. PMID: 36335201; PMCID: PMC9637083.
- ↑ Bleeker FE, Lamba S, Leenstra S, Troost D, Hulsebos T, Vandertop WP, Frattini M, Molinari F, Knowles M, Cerrato A, Rodolfo M, Scarpa A, Felicioni L, Buttitta F, Malatesta S, Marchetti A, Bardelli A. IDH1 mutations at residue p.R132 (IDH1(R132)) occur frequently in high-grade gliomas but not in other solid tumors. Hum Mutat. 2009 Jan;30(1):7-11. doi: 10.1002/humu.20937. PMID: 19117336.
- ↑ Chen X, Ding J. Molecular insights into the catalysis and regulation of mammalian NAD-dependent isocitrate dehydrogenases. Curr Opin Struct Biol. 2023 Oct; 82:102672. doi: 10.1016/j.sbi.2023.102672. Epub 2023 Aug 3. PMID: 37542909