Bacteriorhodopsin (Hebrew)
From Proteopedia
| Line 1: | Line 1: | ||
| - | + | <div dir='rtl' align='right'> | |
| - | < | + | |
== בקטריורידופסין == | == בקטריורידופסין == | ||
| - | </p> | ||
| - | <div dir='rtl' align='right'> | ||
| - | בקטריורודופסין | ||
=== הקדמה === | === הקדמה === | ||
Revision as of 07:00, 25 May 2011
Contents |
בקטריורידופסין
הקדמה
בעלי החיים נבדלים מצמחים בדרך שבה הם משתמשים באור. צמחים וחיידקים פוטוסינתטיים מנצלים את האור הנופל עליהם לייצור חומרי מזון עתירי אנרגיה (סוכרים). לעומתם, בעלי חיים ובני אדם, מנצלים את האור להפעלת חוש הראייה שלהם. אולם בשני המקרים, השלב הראשון של ניצול האור מתחיל בפגיעה של פוטונים בפיגמנטים (מולקולות צבע שקולטות אור באורך גל ספציפי). אלה מגיבים על הפגיעה בדרך מורכבת ופותחים בכך תהליך שרשרת ארוך, שבמקרה אחד (צמחים) מסתיים בייצור סוכר, ובמקרה אחר (בעלי חיים, בני אדם) מסתיים בקליטה של תמונה המועברת לעיבודו של המוח. התהליכים הראשונים האלה מתחוללים בפרקי זמן קצרים במיוחד: פחות ממיליונית מיליונית השנייה. הפיגמנט הבולע את האור בצמחים הוא הכלורופיל. בבעלי חיים ממלאים את התפקיד הזה פיגמנטים המכונים "חלבונים רטינליים". במשך שנים רבות סברו המדענים כי חלבון הרודופסין קיים בבעלי חיים בלבד. אולם, לפני כשלושים שנה, התגלו חיידקים הגדלים בתמלחות (בריכות עם ריכוזי מלח גבוהים במיוחד, ~6M) המכילים חלבון חדש שנימצא דומה לחלבונים הקולטים את האור בתהליך הראייה. בשל הדמיון לחלבון הרודופסין נקרא החלבון החדש בקטריורודופסין.
בקטריורודופסין
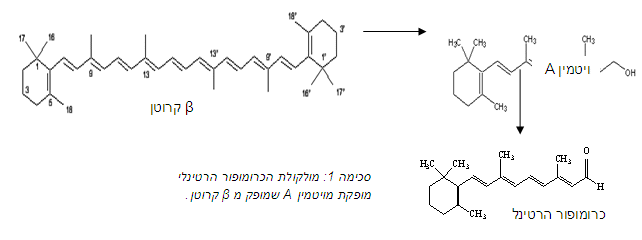
נימצא כי חלבון זה מתמיר את אנרגיית האור לאנרגיה כימית ובכך משמש כמערכת פוטוסינתטית בטבע שאינה מבוססת על כלורופיל. בקטריורודופסין, הוא פיגמנט סגול (בעל שיא בליעה ב-nm 570) הנמצא בהלובקטריום סלינארום, מיקרו-אורגניזם הלופילי ("אוהב מלח"). זהו חלבון בעל משקל של kDa 25, שמורכב מ- 7 סלילי אלפא החוצים את ממברנת התא ההידרופובית. חלבון זה מקובע בתוך הממברנה ובתוכו נוצר כיס שמהווה אתר קישור למולקולת רטינל בצורתה ה- all trans. הרטינל היא מולקולת כרומופור שמורכבת מ- 20 פחמנים שמסודרים בקשרים כפולים הבונים מערכת מצומדת הבולעת אור בתדרי האור הנראה. הרטינל, שייך למשפחת הקרטינואידים והוא נוצר מחמצון של ויטמין A שמופק מבטא-קרוטן (סכימה 1). בבקטריורודופסין, מולקולת הרטינל קשורה לחלבון בקשר קוולנטי לחומצה האמינית ליזין בעמדה 216 (שייר אמיני השמור בחלבוני הרטינל). הקישור בין הליזין לבין הרטינל יוצר את הקשר Protonated Schiff Base (PSB) הטעון במטען חיובי וזאת כאמור, בלב אזור הידרופובי. חומצות אמיניות העוזרות בייצוב המטען החיובי של ה- PSB הן Asp85 (חומצה אספרטית הממוקמת במקום ה-85 ברצף החומצות האמיניות בחלבון), Asp227 ו-Arg94.
ברגע שנקלט פוטון בבקטריורודופסין נוצרים שינויים חשמליים במולקולת הרטינל, המשרים שינויים בחלבון וגורמים להוצאת פרוטון מתוך התא אל מחוצה לו. כתוצאה מכך נוצר מפל ריכוזים. מפל זה ניתן לתרגום לאנרגיה אלקטרוכימית (חשמלית) המתורגם לאנרגיה כימית.
כיצד זה קורה?
קליטת הפוטון ע"י הרטינל (שיא בליעהnm 570) גורמת להפיכת הקשר הכפול בעמדה 13 מטרנס לציס וזה מוביל לשינויים בפיזור המטען החשמלי על פני המולקולה. שינוי זה משרה שינוי מרחבי של סלילי האלפא, שביניהם נמצא הרטינל, ובין היתר פגיעה במשיכה האלקטרוסטטית בין המטען החיובי של ה- PSB למטען השלילי של Asp85 . כתוצאה משינוי זה מתחילה שרשרת תגובות כימיות בחלבון, במהלכו נע מיקום המטען החיובי (הפרוטון) שעל ה- PSB. למשל בתחילת מעבר הפרוטון, החומצה האמינית (Asp85) שטעונה במטען שלילי עוברת פרוטונציה והופכת לניטרלית מבחינה חשמלית. בהמשך נע, כאמור, המטען לאורך החלבון עד שמגיע לחומצות האמינו Glu194 ו- Glu204 שיושבות בקרבת חוץ התא ואחראיות לשחרור הפרוטון מחוצה לממברנת התא. בסוף התהליך חוזרת מולקולת הבקטריורודופסין למבנה ההתחלתי ויכול להתחיל מחזור חדש. מחזור כזה ניקרא מעגל אור שמסתיים תוך כמה מילי שניות ובו המולקולה משנה את התכונות האופטיות שלה. ניתן לזהות ספקטרוסקופית את כל מצבי הביניים המתקבלים במעגל האור. יש לציין שבמהלך תגובת השרשרת שמסתיימת בהוצאת הפרוטון אל מחוץ התא משתנה מערך קשרי המימן במולקולה ויש שיתוף של מולקולות מים.
ספטרום הבליעה של בקטריורודופסין
ספטרום הבליעה של בקטריורודופסין תלוי ב pH: כאשר מורידים את ה pH לאיזור החומצי (pH<5), החלבון עובר הסחה אדומה ומשנה את מקסימום הבליעה שלו מ- 568nm ל- 605nm והופך מסגול לכחול. נימצא שיצירת הצורה הכחולה מתרחשת בזמן ש- Asp85 עוברת פרוטונציה וזה מה שמעורר את ההסחה האדומה של ספקטרום בליעה, בעקבות ביטול האנטרקציה האלקטרוסטטית (חשמלית) בין ה- PSB לבין Asp85. מעבר זה מאופיין ב- pKa בסביבות 2.6 עבור Asp85. ה- pKa של Asp85 יכול להשתנות מהסיבות הבאות: 1) שינויי מבנה של החלבון כמו למשל, שינוי בחומצות האמינו הקרובות ל- Asp85 או הנימצאות באתר הקישור של הרטינל או בשטח הפנים של הממברנה. 2) החלפה של הרטינל הכרומופורי ברטינלים סינטטים אחרים. 3) שינויים בממברנה או אסטרפיקציה של קבוצות קרבוקסיליות.