Trypsin (Hebrew)
From Proteopedia
| Line 51: | Line 51: | ||
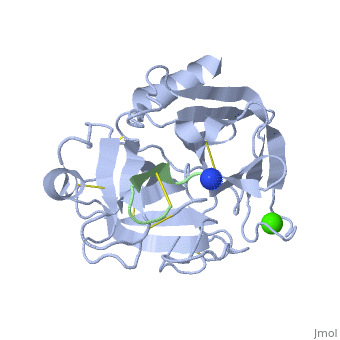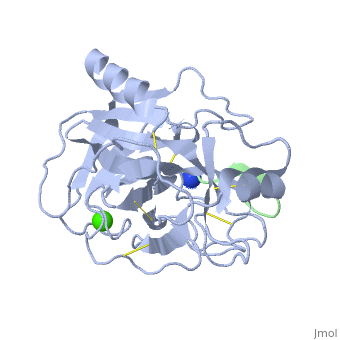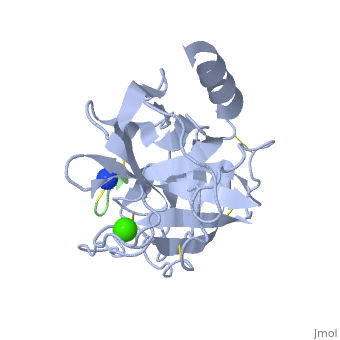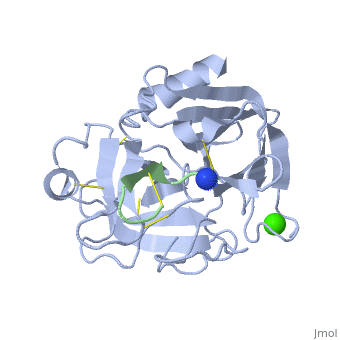
בתמונה, כל סוג של חומצה אמינית מסומנת בצבע אחר. רצף חומצות האמינו בחלבון . <scene <scene name='Trypsin_(Hebrew)/Helixsheet/2'>המבנה | בתמונה, כל סוג של חומצה אמינית מסומנת בצבע אחר. רצף חומצות האמינו בחלבון . <scene <scene name='Trypsin_(Hebrew)/Helixsheet/2'>המבנה | ||
| - | [http://proteopedia.org/wiki/images/3/3f/Trypsin_primary_structure.doc מצורף כאן] | + | [http://proteopedia.org/wiki/images/3/3f/Trypsin_primary_structure.doc מצורף כאן p] |
השניוני </scene>של החלבון מכיל helix (סגול) -ו β sheet (ירוק). המבנה בתמונה גובש כקומלפקס עם הורמון | השניוני </scene>של החלבון מכיל helix (סגול) -ו β sheet (ירוק). המבנה בתמונה גובש כקומלפקס עם הורמון | ||
Vasopressin <scene name='Trypsin_(Hebrew)/Adh/4'>וזופרסין</scene>, הורמון זה מהווה מעכב לאנזימי סרין פרוטאז כדוגמת טריפסין. | Vasopressin <scene name='Trypsin_(Hebrew)/Adh/4'>וזופרסין</scene>, הורמון זה מהווה מעכב לאנזימי סרין פרוטאז כדוגמת טריפסין. | ||
Revision as of 11:29, 19 June 2012
|
טריפסין הוא אניזים הפועל בלבלב, מפרק חלבונים לשרשראות קצרות או פרוק סופי לחומצות אמינו. המילה טריפסין מורכבת משתי מילים, המילה Tribo שפירושה משולש והמילה Trypsis שפירושה בלייה או עיכול. אנזים טריפסין הוא מסוג סרין פרוטאז המפרק קשרים פפטידיים בחלבון. טריפסין התגלה לראשונה על ידי Kuhne, שחקר את הפעילות הפרוטאוליטית של האנזים בשנת 1876. בשנת 1931 האנזים טוהר, ומאוחר יותר בשנת 1974 נקבע המבנה התלת מימדי של טריפסין. האנזים מיוצר ומופרש על-ידי תאים אקסוקריניים (תאים המפרישים מיצי עיכול לחלל המעי) של הלבלב בצורת זימוגן = אנזים לא פעיל, הנקרא טריפסינוגן, שהופך לצורה הפעילה שלו באמצעות האנזים אנטרוקינז בחלל המעי הדק - בתרסריון, וכך מתקבל הטריפסין הפעיל. בתמונה הבאה רואים מבנה של טריפסינוגן בהשוואה לטריפסין. טריפסין בתרסריון בעל יכולת לשפעל מולקולות נוספות של טריפסינוגן ולהפוך אותם לצורה הפעילה. שפעול האנזים נעשה ע"י תהליך חיתוך פרוטאוליטי שגורם לחשיפת האתר הפעיל של האנזים. שלב החלבון כזימוגן הכרחי על מנת שלא לפגוע בחלבונים שלא לצורך, כך יש אפשרות לבקר את היכולת של טריפסין לפרק חלבונים בתנאים מסוימים.
אופן פעילותו ותנאים מיטביים
האנזים טריפסין מפרק חלבונים לפטטידים שונים או לחומצות אמינו ע"י פרוק קשרים פפטידיים : הפרוק נעשה ע"י חיתוך הצד הקרבוקיסלי c-terminal, של חומצות אמינו ליזין וארגינין (בתנאי שלא נמצאות בשרשרת לפני החומצה פרולין). המשיכה של חלבונים לאתר הפעיל של טריפסין נעשית ע"י משיכה חשמלית בין חומצות אמינו ליזין וארגינין הטעונות חיובית לבין חומצה אספרטית השלילית הנמצאת באתר הקטליטי של האנזים. האנזים פעיל בתנאים אופטימליים PH-8 (בניגוד לאנזים פפפסין הפועל ב pH חומצי ) ובטמפרטורה של 37 מעלות צלזיוס. של האנזים מכיל שלוש חומצות הקרויות "השילוש הקטליטי"- סרין , היסטדין וחומצה אספרטית (ניתן לעמוד על כל אחת מהחומצות בתמונה ולקבל אינפורמציה נוספת).
יישומים
נעשה מחקר יישומי רב עם אנזים זה כיוון שניתן להפיק כמויות גדולות ומטוהרות . מעצם היותו סרין פרוטאז, הוא משמש ליישומים רבים, בניהם: מחקר על עיכול חלבונים וזיהוי הפפטידים שמתקבלים, שימושים ברפואה כגון המסת קרישי דם וטיפול בדלקת, הכנת מזון תינוקות ועוד.
מבנה
לאינזים טריפסין 223 בתמונה, כל סוג של חומצה אמינית מסומנת בצבע אחר. רצף חומצות האמינו בחלבון . של החלבון מכיל helix (סגול) -ו β sheet (ירוק). המבנה בתמונה גובש כקומלפקס עם הורמון Vasopressin , הורמון זה מהווה מעכב לאנזימי סרין פרוטאז כדוגמת טריפסין. טריפסין, אחראי לביקוע קשר פפטידי של חומצה אמינית בעלת מטען חיובי, מבקע אחרי חומצות אמיניות ארגינין וליזין. וזופרסין נחשב למעכב חזק ויעיל, כוון שהוא נמשך ונכנס לאתר הפעיל של הטריפסין, בזכות בין החומצה אספרטית בכיס הפעיל שהיא שלילית וארגינין החיובית הנמצאת בהורמון זה, בחלבון רגיל נעשה לאחר האריגינין חיתוך, אך בוזופרסין לפני הארגינין יש חומצה אמינית פרולין, דבר שמונע את החיתוך כאן. וגם ע"י יצירת קשרי מימן בין ציסטאין וארגינין בוזופרסין לסרין (214) לגליצין (216) בטריפסין, גורמים לקשר חזק בין טריפסין לוזופרסין ובכך הוזופרסין מהווה מעכב יעיל לאינזים זה .
נספחים