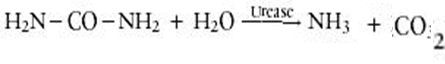This old version of Proteopedia is provided for student assignments while the new version is undergoing repairs. Content and edits done in this old version of Proteopedia after March 1, 2026 will eventually be lost when it is retired in about June of 2026.
Apply for new accounts at the new Proteopedia. Your logins will work in both the old and new versions.
Urease (Hebrew)
From Proteopedia
(Difference between revisions)
| Line 23: | Line 23: | ||
==<center>מבנה המולקולה</center>== | ==<center>מבנה המולקולה</center>== | ||
<p dir='rtl'> | <p dir='rtl'> | ||
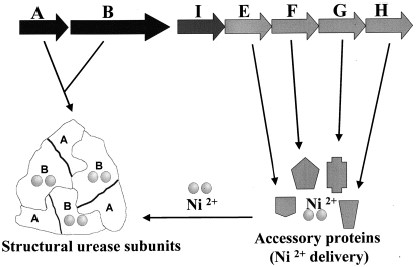
| - | האוראז בהליקובקטור פילורי הוא חלבון גדול מאוד, ובנוי מיחידות רבות, 807 <scene name='76/761650/Amino_acids/2'>חומצות אמינו</scene> (כל סוג חומצת אמינו מוצגת בצבע אחר) | + | האוראז בהליקובקטור פילורי הוא חלבון גדול מאוד, ובנוי מיחידות רבות, 807 <scene name='76/761650/Amino_acids/2'>חומצות אמינו</scene> בכל יחידה (כל סוג חומצת אמינו מוצגת בצבע אחר), הבנויה מתת יחידות <scene name='76/761650/Alfa_amino_acids/1'>α</scene> ו- <scene name='76/761650/Beta_amino_acids/1'>β</scene>, המבנה הראשוני של כל תת יחידה מורכב מ[http://www.uniprot.org/uniprot/P14916.fasta 238] ח.א ו-[http://www.uniprot.org/uniprot/P69996.fasta 569] ח.א בהתאמה, ומסתם המולקולרית של שתי תת היחידות היא כ-550kDa. |
<scene name='76/761650/Helix_sheets/3'>המבנה השניוני</scene> הוא סלילי α ומשטחי β. | <scene name='76/761650/Helix_sheets/3'>המבנה השניוני</scene> הוא סלילי α ומשטחי β. | ||
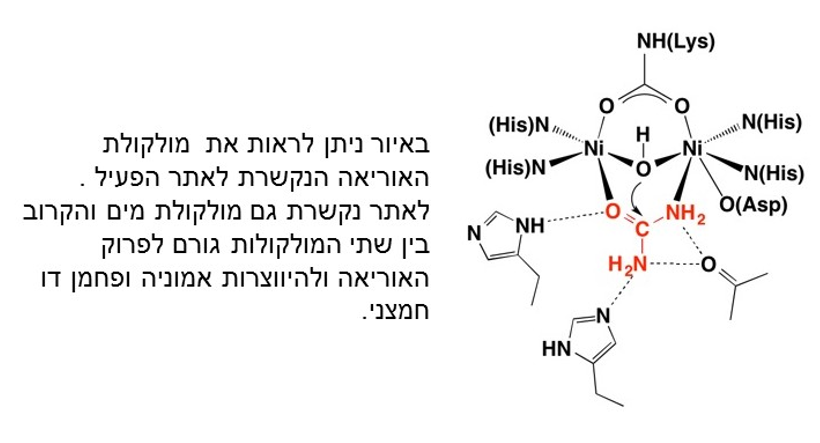
| - | <scene name='76/761650/Active_site/1'>האתר הפעיל</scene> בנוי מחומצות האמינו היסטידין 136, היסטידין 138, ליזין 219, היסטידין 248, היסטידין 274, ואספרטאט 362 המתקרבות [https://he.wikipedia.org/wiki/%D7%9E%D7%91%D7%A0%D7%94_%D7%A9%D7%9C%D7%99%D7%A9%D7%95%D7%A0%D7%99 במבנה השלישוני] בעקבות יצירת קשרים בין מולקולריים ובאות במגע ישיר עם שני <scene name='76/761650/Nickel_ion/2'>יוני ניקל</scene> | + | <scene name='76/761650/Active_site/1'>האתר הפעיל</scene> בנוי מחומצות האמינו היסטידין 136, היסטידין 138, ליזין 219, היסטידין 248, היסטידין 274, ואספרטאט 362 המתקרבות [https://he.wikipedia.org/wiki/%D7%9E%D7%91%D7%A0%D7%94_%D7%A9%D7%9C%D7%99%D7%A9%D7%95%D7%A0%D7%99 במבנה השלישוני] בעקבות יצירת קשרים בין מולקולריים ובאות במגע ישיר עם שני <scene name='76/761650/Nickel_ion/2'>יוני ניקל</scene> (המוצגים בלבן). |
| - | + | ||
<br> | <br> | ||
| - | למרות ההבדל בין מבנה האוראז בחיידק ובצמח האתר הפעיל | + | היסטידין 221 והיסטידין 322 הסמוכים לאתר הפעיל יוצרים קשר עם האוריאה והמים לזרוז תהליך הפיכת האוריאה לאמוניה, האתר הפעיל של האנזים נמצא בתת יחידה β. |
| + | להליקובקטר שישה עותקים לכל אחת משתי תת היחידות, <scene name='76/761650/A_unit/5'>α</scene> ו- <scene name='76/761650/B_unit/4'>β</scene>, ולכן שישה אתרים פעילים למולקולת האנזים הטעונה במלואה. | ||
| + | <br> | ||
| + | למרות ההבדל בין מבנה האוראז בחיידק ובצמח האתר הפעיל דומה בשניהם. | ||
במיקרוסקופ אלקטרונים אוראז נראה במבנה[https://drive.google.com/open?id=0B0r4OgEiZ5e_bnJCQW91Nmw4b0U כדורי חלול במרכז], האנזים בעל קוטר של 13 ננומטר ובעל סימטריה סיבובית. | במיקרוסקופ אלקטרונים אוראז נראה במבנה[https://drive.google.com/open?id=0B0r4OgEiZ5e_bnJCQW91Nmw4b0U כדורי חלול במרכז], האנזים בעל קוטר של 13 ננומטר ובעל סימטריה סיבובית. | ||
Revision as of 20:23, 11 July 2017
אוראז
| |||||||||||