רקע
Nuclear Factor kappa-light-chain-enhancer of activated B cells)
) מורכב מחלבונים ממשפחת חלבונים שנקראים Rel, המשותף ביניהם הוא שכולם מהווים
גורמי שעתוק גנים (חלבון הנקשר לרצף DNA ספציפי, הנמצא לפני החלק המקודד של הגן, ובכך משפיע על שעתוק הגן לmRNA).
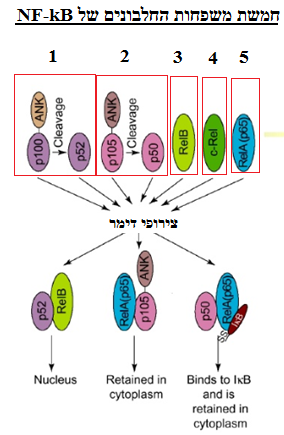
NF-kB מורכב מחמש משפחות חלבונים
: P100/P52, P105/P50, Rel B, c-Rel, Rel A.
כאשר צירופים של משפחות אלו, יוצרים סוגי קומפלקסים הטרודימרים או הומודימרים שונים של NF-kB , בעלי תיפקודים שונים.
הוא החלבון שגובש בשיטת קריסטלוגרפיה, בעל (מסומן בצבע צהוב) לקישור החלבון עם הDNA.
NF-kB מהווה
החלבון נתגלה ב 1986 כפעיל בעיקר בתאי B ובתאים לימפוציטים, תאי מערכת החיסונית.
בהמשך המחקר הסתבר שפעילות אקסוגנית (סיגנלים המעבירים מסרים מחוץ לתא אל פנים התא) גורמים לשיפעול NF-kB הנמצא בציטופלזמה של כל סוגי התאים בגוף, וכן זוהו אתרי קישור יעודים ל NF-kB בפרומוטורים (אזור קדם שיעתוק) של גנים רבים, P50 הוא גורם בקרה
פליאוטרופי
חשוב.
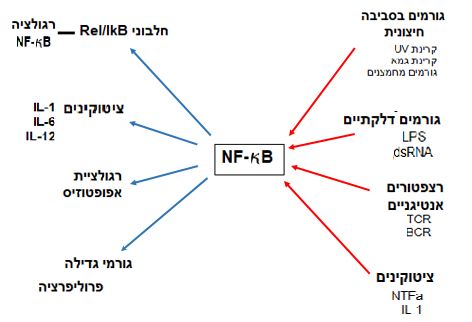
NF-kB אחראי לבקרת גנים שונים:
הפעלת תגובות חיסוניות ודלקתיות , בתגובות למצבי דחק וויסות תהליכי התרבות מהירה של תאים (פרוליפרציה) ותהליכי תמותת תאים מתוכננת (אפופטוזיס), גדילה, התמיינות והתפתחות תאים, התפתחות עוברית, פיזיולוגיה של העצם, העור ומערכת העצבים.
השראת הפעלה של NF-kB נצפתה גם בעקבות חשיפה למצבים פיזיקליים כמו קרינת גמא או קרינת UV.
כך, המצאות NF-Kb ופעילותו, חיונית לפעילות מגוונת הנגרמת כתוצאה מגירויים חיצוניים שונים ומהווה אלמנט מרכזי בתהליכים פיזיולוגיים ופתולוגיים מגוונים ובכל סוגי התאים.
מבנה החלבון
בסעיף זה נעסוק רק במבנה החלבון p50, משום שזה החלבון שגובש, אם כי נזכיר את תת היחידה השנייה
הקשורה אל החלבון, כתנאי הכרחי בבניית גורם השיעתוק.
במבנה שמוצג נראית
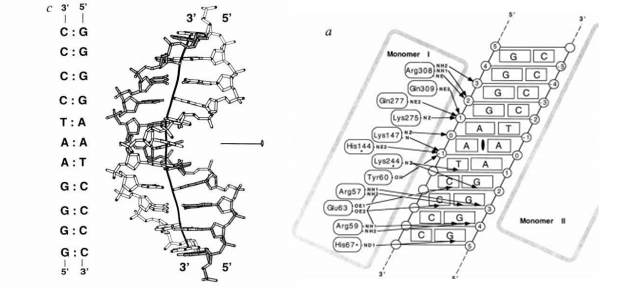
מבנה הדימר של p50 שגובש, אורכו (aa 2-366) כל צבע מייצג חומצה אמינית שונה, צולם בעזרת קריסטלוגרפית קרני X.
ניתן לזהות במבנה השניוני של החלבון מבני (Alpha Helix), מבני (Beta Sheet) .
בחלבון p50 ניתן לזהות מספר אזורים חשובים:
1. RHD- Rel Homolog Domain- אתר הומולוגי שמור בכל משפחת חלבוני Rel–מהווה אתר הקישור ל DNA.
אורכו 300 חומצות אמיניות. מאופיינים בשני אתרים מרוחקים הנקשרים לDNA:
האתר הקטן יותר בקצה הקרבוקסילי- (245-366 חומצות אמיניות) C-terminal יוצר את שטח המגע ומספר אינטראקציות בין פוספט ל DNA.
הגדול יותר הקצה האמיני (2-244 חומצות אמיניות)- N-terminal יוצר לולאת היכרות המגיבה עם בסיסי ה DNA.
DNAעם ה NFkB אתר הקישור העיקרי של - P50
בערך זה נשים דגש על אתר הקישור של NFkB בדנ"א - אתר זה נקרא P50
p50 הומודימר של NFkB הקשור ל DNA, נמצא בגרעין של מספר סוגי תאים. אחת המטרות החשובות של החלבון הוא אתר MHC (major histocompatibility complex ).
האזור ההומולוגי של RHD מאופיין בשני אתרי beta-barrel, אשר נקשרים ל DNA באזור ה major groove.
שני הדומיינים נקשרים לשלד ה DNA כאשר, הקצה ה amino-terminal domain (ATD) יוצר לולאת
היכרות המגיבה עם בסיסי ה DNA. ה C-terminal domain אתר דימריזציה המתקשר עם IkB.
ב P50 של NFkB יש כ 435 שיירי חומצות אמינו.
הרפרסור p105 כולל רצף ankyring repeats ב C-terminal. הסרה פרוטאוליטית של רצף זה
תאפשר הובלת p50 אל הגרעין.
ה RHD של p50 כולל שני דומיינים מרוחקים:
הקטן יותר C-terminal domain(245-366) יוצר את שטח המגע ומספר גדול של אינטראקציות פוספט עם
הDNA.
הגדול יותר , מכיל שיירים (2-244) המתקשרים עם בסיסי ה DNA.
השיירים 43-244 נראים היטב בקריסטלוגרפיה.
שיירים 160-205 אינם חלק מרצף הקונצנזוס של Rel, והם יוצרים מבנה קומפקטי של alpha helix
חלקי, בתוך הדומיין.
המקטע הקצר המחבר בין שני הדומיינים משמש כציר, משום שהדימר אוחז ב 11 זוגות בסיסי ה
DNA כלסתות וצריך להיפתח כדי לעטוף את הסליל הכפול.
דיאגרמה סכמטית של האינטראקציות הפולריות בין p50 ו 11bp של ה DNA. אינטראקציות בין החלבון לבין ה DNA מסומנות בחיצים. אינטראקציות בתוך החלבון מסומנות בקים. His 67, His 144, Lys 244- אינם זהים בין p50 ל p65.
הסליל הכפול של ה DNA הנמצא באנטראקציה עם
NF-Kb P50: הכיפוף הסלילי בקו מודגש, ה DNA "מתכופף" לכיוון הדומיינים הממוקמים בסמוך
ל major groove בצד ימין של ה DNA.
שימור אבולוציוני
הקומפלקס NF-kB, נמצא בתאים הומניים ונתגלה גם גם בתאי בעלי חיים ממחלקות שונות כמו: נבוביים כמו אלמוגים והידרה, ספוגיים, חרקים כמו תאי עשים, ייתוש וזבוב הפרות ועוד.
ריצוף הגנום של בעלי חיים אלה מאפשר השוואה במבנה החלבון בבעלי החיים השונים, ולהעריך את השינויים האבולוציוניים בחלבון ה NFKN.
וכן נמצא שקיימים לאורך כל סוגי המחלקות של בעלי החיים, האתרים השמורים מסומנים בצבע סגול כהה ואילו אתרים לא שמורים מסומנים בצבע כחול (ניתן להיעזר בתמונה המצורפת עם מדדי השמירה האבולוציונית בצבעים השונים), האתר השמור ביותר הוא אתר הקישור של החלבון NF-kB עם הDNA (אתר RDH).
NFkB מסלול מעבר אותות של
מעבר אותות בתא הוא תהליך שבו מומר סוג אחד של מולקולת אות לסוג/ים אחרים.
תהליך מעבר האותות כולל סדרת תגובות ביוכימיות, מהירות, המתווכות באמצעות אנזימים והפעלת שליחים שניוניים.
בסיום התהליך מתקבל שינוי או תגובה של מערכת או מספר מערכות בתא.
מסלול מעבר אותות בתא מאפשר בקרה
בשלבים השונים של המסלול.
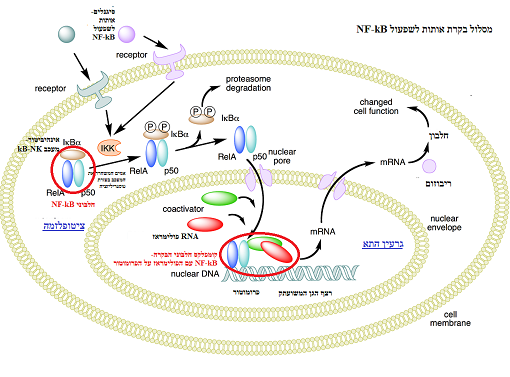
שפעול החלבון NF-kB
כפקטור שיעתוק בתא באמצעות מסלול בקרת אותות בציטופלסמה ובגרעין:
א. בציטופלסמה
היחידות החלבוניות הבונות את ה NFkB
הן מולקולות גדולות (p105, p100 וכו').
בעקבות סיגנלים תאיים, מתרחש תהליך שיפעול, אשר במהלכו אנזים מסוג קינאז IKK
מבצע פוספורילציה (זירחון) לתת היחידות החלבוניות,
אשר מוביל לחיתוך מולקולת חלבון הגדולות למולקולות קטנות יותר. המולקולות הקטנות הן אלה שיכולות להכנס לגרעין התא
חלבוני NF-kB
נמצאים בציטוזול שבציטופלזמה קשורים למולקולות חלבון מקבוצת
IkB's , IkB's מהווים מעכבים של NF-kB.
בסביבה החיצונית. משום היותו פקטור תיעתוק של גנים רבים, המשופעל על ידי גירויים מגוונים (סיגנלים- אותות חוץ תאיים), מתקיימים בו מעגלי בקרה רבים המבוססים על הולכת אותות תאים, בקרה ציטופלסמטית (בציטופלזמה) ובקרת שיעתוק (בגרעין התא) לשפעול NF-kB בעצמו, להפיכתו לפעיל על מנת שיוכל לחדור מהציטופלזמה לגרעין התא .
בכל מסלולי האיתות בתא המובילים להשראת NF-kB , קיימת פעילות האנזים IKB קינאז (IKK) המבצע פוספורילציה של IKB (המעכב) כך גורם לניתוקו מהדימר שאליו מחובר לNF-kB ובהמשך מוביל אותו לדגרדציה (פירוק).
רגולציה נוספת של פעילות NF-kB מתבצעת על ידי שינויים שלאחר התיעתוק של מרכיבי החלבון NF-kB:
NF-kB, IKB's, ו IKK's, ובתהליכים רב שלביים בציטופלסמה.
דף התלמיד
מקורות מידע
1. ;Müller CW, Rey FA, Sodeoka M, Verdine GL, Harrison SC (January 1995). "Structure of the NF-kappa B p50 homodimer bound to DNA". Nature.
2. https://www.creative-diagnostics.com/The-NF-kB-Signaling-Pathway.htm
3. The NF-kappaB family of transcription factors and its regulation.
4. The complexity of NF-κB signaling in inflammation and cancer





