ACE2 (Hebrew)
From Proteopedia
| Line 19: | Line 19: | ||
<p dir='rtl'>ACE2 הוא חלבון שמורכב מ-805 <scene name='84/847567/Ace2_amino_acid/3'>חומצות אמינו</scene>. רצף חומצות האמינו מהווה את המבנה הראשוני של החלבון. בין חומצות האמינו הסמוכות קיימים קשרים פפטידיים. קשרי מימן הנוצרים בין חומצות אמינו שונות לאורך המבנה הראשוני של החלבון יוצרים מבנה מרחבי המקפל את החלבון לשתי צורות עיקריות של <scene name='84/847567/Secondary_structure/4'>מבנים שניוניים</scene>: סליל אלפא (בצהוב) ומשטח בטא (בירוק) | <p dir='rtl'>ACE2 הוא חלבון שמורכב מ-805 <scene name='84/847567/Ace2_amino_acid/3'>חומצות אמינו</scene>. רצף חומצות האמינו מהווה את המבנה הראשוני של החלבון. בין חומצות האמינו הסמוכות קיימים קשרים פפטידיים. קשרי מימן הנוצרים בין חומצות אמינו שונות לאורך המבנה הראשוני של החלבון יוצרים מבנה מרחבי המקפל את החלבון לשתי צורות עיקריות של <scene name='84/847567/Secondary_structure/4'>מבנים שניוניים</scene>: סליל אלפא (בצהוב) ומשטח בטא (בירוק) | ||
מבנה החלבון נחקר ממקורות שונים באמצעות קריסטלוגרפיה בקרני X. מהשוואת מבנה החלבון בין מינים שונים של יצורים עולה דמיון רב שמעיד על אזורים שמורים בחלבון כמו האתר הפעיל , ו<scene name='84/847567/Metal_binding_sites/4'>אתרים קושרי אבץ</scene></p> | מבנה החלבון נחקר ממקורות שונים באמצעות קריסטלוגרפיה בקרני X. מהשוואת מבנה החלבון בין מינים שונים של יצורים עולה דמיון רב שמעיד על אזורים שמורים בחלבון כמו האתר הפעיל , ו<scene name='84/847567/Metal_binding_sites/4'>אתרים קושרי אבץ</scene></p> | ||
| + | |||
| + | <scene name='84/847567/Active-sites/1'>האתרים הפעילים</scene> | ||
---- | ---- | ||
Revision as of 09:38, 30 June 2020
Contents |
2 אנזים מהפך אנגיוטנסין
|
אנזים מהפך אנגיוטנסין 2 (Angiotensin Converting Enzyme 2- ACE2)הוא אנזים חוצה ממברנה, שנמצא על מעטפת התא. האנזים מתבטא ופעיל בסוגי תאים שונים כולל תאי אפיתל של נאדיות הריאה, המעי הדק, ותאי האנדותל בכלי דם, בלב ובכליות. תפקידו המקורי של האנזים בגוף שלנו הוא לפרק הורמון בשם אנגיוטנסין 2, הורמון שמשתתף במנגנון ויסות ובקרה אשר שומר על לחץ דם תקין. בנוסף, ACE2 מעורב בוויסות תפקוד הלב מה שהופך אותו למטרה תרופתית מבטיחה לטיפול במחלות לב. האנזים משמש גם כקולטן המהווה נקודת כניסה עבור כמה סוגים של נגיף הקורונה לתאים.
ACE2 חשיבותו של האנזים
ACE2 הינו אנזים חשוב במערכת רנין-אנגיוטנסין-אלדוסטרון (Renin-Angiotensin-Aldosterone-System-RAAS) שמהווה מן שחקן מפתח בבקרה על תהליכים שונים בגופנו, בעיקר בשמירה על נפח ולחץ הדם שלנו. מערכת ה-RAAS מופעלת בשלבים: (1) תאים ייחודים בכליה "חשים" בירידה בלחץ הדם, וכתגובה משחררים אנזים בשם רנין (Renin) (2) הרנין חותך פפטיד לא פעיל הנקרא: אנגיוטנסנוגין (Angiotensinogen), והופך אותו להורמון בשם אנגיוטנסין I (Angiotenin I (3) בנימי הריאה נמצא אנזים ACE אנזים שמהפך אנגיוטנסין I (Angiotensin converting enzyme-ACE), האנזים ACE חותך את ההורמון אנגיוטנסין I והופך אותו לאנגיוטנסין II (4) אנגיוטנסין II הוא התוצר הסופי של המערכת, הוא פועל כהורמון בעל תפקידים רבים, וביניהם: מעודד את בלוטת יותרת הכליה להפריש את הורמון האלדוסטרון, שגורם לספיגה חוזרת של יוני הנתרן בנפרון, ובעקבותיהם, מוגברת הספיגה החוזרת של המים לדם, מה שמעלה את נפח הפלסמה, וגורם לעלייה בלחץ הדם. האנגיוטנסין II מעודד את בלוטת יותרת המוח להפריש את הורמון ה-ADH הגורם גם הוא לספיגה חוזרת של מים. ובנוסף לזה, הוא מכווץ כלי דם, מה שמביא להעלאת לחץ הדם. האנזים ACE2 פועל בניגוד למערכת ה- RAAS ועל כן הוא מאפשר הרחבת כלי דם, הורדת לחץ הדם. ACE2 משתתף גם בהפעלת נוגדי חמצון, ויש לו אפילו השפעה מיטיבה על רקמת הריאה ומערכת הנשימה.
ACE2 הפעילות של
האנזים ACE2 חיוני לבקרה שלילית של מערכת הרנין-אנגיוטנסין-אלדוסטרון (RAAS) הקריטית בוויסות של נפח הדם, ו שמירה על הומאוסטזיס במערכת הלב וכלי הדם. האנזים ACE2 מוריד את לחץ הדם על ידי זירוז ריאקציית ההידרוליזה (פירוק באמצעות מולקולת מים ) של מולקולה בשם אנגיוטנסין 2 למולקולה בשם אנגיוטנסין 1.
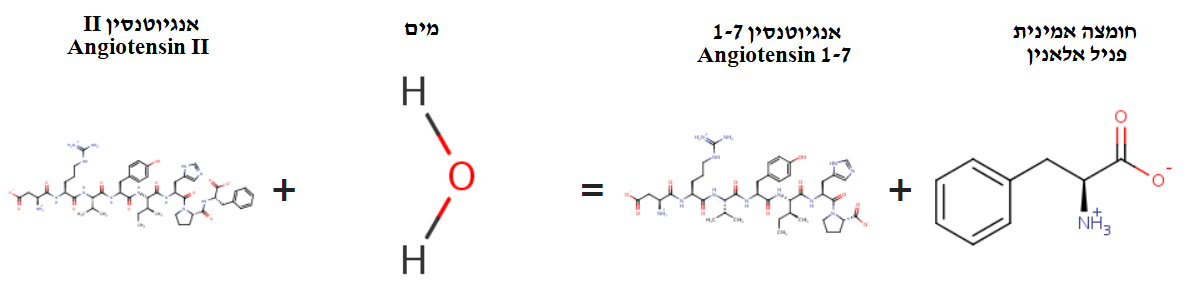
בנוסף, האנזים מבצע חיתוך פרוטאוליטי של פפטידים , כלומר שובר פפטידים ביולוגיים נוספים, פפטידים אשר תורמים לכיווץ של כלי הדם, מה שיכול להסביר את ההפחתה של לחץ הדם כהשפעה מפעילות האנזים.
ACE2 המבנה של
ACE2 הוא חלבון שמורכב מ-805 . רצף חומצות האמינו מהווה את המבנה הראשוני של החלבון. בין חומצות האמינו הסמוכות קיימים קשרים פפטידיים. קשרי מימן הנוצרים בין חומצות אמינו שונות לאורך המבנה הראשוני של החלבון יוצרים מבנה מרחבי המקפל את החלבון לשתי צורות עיקריות של : סליל אלפא (בצהוב) ומשטח בטא (בירוק) מבנה החלבון נחקר ממקורות שונים באמצעות קריסטלוגרפיה בקרני X. מהשוואת מבנה החלבון בין מינים שונים של יצורים עולה דמיון רב שמעיד על אזורים שמורים בחלבון כמו האתר הפעיל , ו
