User:Cristiane Custodio Ross Matheus/Sandbox 1
From Proteopedia
(Difference between revisions)
| Line 13: | Line 13: | ||
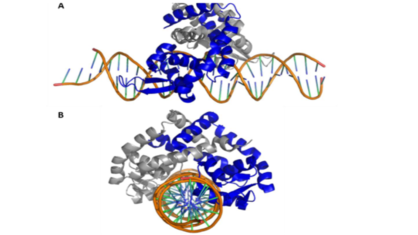
'''OhrR''' é um fator transcricional caracterizado por ser uma proteína repressora e o principal fator regulatório do gene Ohr na maioria dos microrganismos. Essa proteína se encontra sobre o promotor do gene da Ohr e tem a sua estrutura alterada quando oxidada, ao entrar em contato com hidroperóxidos de ácidos graxos e peroxinitritos. Com a mudança de conformação gerada pela oxidação da OhrR ocorre o seu desprendimento do promotor do gene, fazendo com que o mesmo se torne mais acessível a RNA polimerase, ocorrendo por consequência uma superexpressão do gene da Ohr. Além da OhrR também foram encontrados em alguns microrganismos meios regulatórios distintos para o gene da Ohr. Um exemplo é a regulação positiva pelo fator sigma alternativo, presente em alguns microrganismos | '''OhrR''' é um fator transcricional caracterizado por ser uma proteína repressora e o principal fator regulatório do gene Ohr na maioria dos microrganismos. Essa proteína se encontra sobre o promotor do gene da Ohr e tem a sua estrutura alterada quando oxidada, ao entrar em contato com hidroperóxidos de ácidos graxos e peroxinitritos. Com a mudança de conformação gerada pela oxidação da OhrR ocorre o seu desprendimento do promotor do gene, fazendo com que o mesmo se torne mais acessível a RNA polimerase, ocorrendo por consequência uma superexpressão do gene da Ohr. Além da OhrR também foram encontrados em alguns microrganismos meios regulatórios distintos para o gene da Ohr. Um exemplo é a regulação positiva pelo fator sigma alternativo, presente em alguns microrganismos | ||
| - | + | [[Image:Captura_de_Tela_(6).png|left|430px]]<br /> | |
==Structural features== | ==Structural features== | ||
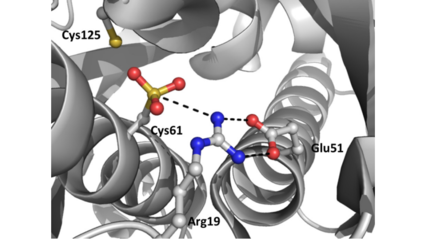
Ohr apresenta características estruturais e bioquímicas distintas quando comparada a peroxidases baseadas em Cys de mamíferos. Essa proteína apresenta estrutura semelhante à de um barril formada por um homodímero firmemente dobrado, no qual duas folhas β, de seis fitas, envolvem duas α-hélices centrais. Há dois locais ativos na enzima que se encontram localizados na interface do dímero em lados opostos da proteína. A arquitetura do sítio catalítico de Ohr é composta por duas cisteínas, a peroxidática e a de resolução. A Cisteína peroxidática, localizada em uma das α-hélices centrais, tem por função a reação direta com hidroperóxidos, formando um ácido sulfênico. Este por sua vez se condensa com a Cisteína de resolução para formar uma ligação dissulfeto intramolecular. Além dos dois aminoácidos de Cys há também a presença de uma Arginina catalítica e um Glutamato que tem extrema importância na atividade da enzima Ohr, uma vez que ajudam a estabilizar a Cys em seu estado de tiolato através de interações polares, aumentando sua nucleofilicidade. O grupo carboxílico do glutamato catalítico orienta o grupo guanidínio da Arginina em direção a Cisteína, em uma configuração que parece ser ideal para a redução de hidroperóxidos orgânicos. Esse processo de estabilização descrito é o chamado estado fechado da tríade catalítica. No estado aberto ocorre o rompimento das interações e consequente mudança conformacional que acaba expondo o resíduo ao solvente, sendo esse último estado o mais propício para a redução da Ohr | Ohr apresenta características estruturais e bioquímicas distintas quando comparada a peroxidases baseadas em Cys de mamíferos. Essa proteína apresenta estrutura semelhante à de um barril formada por um homodímero firmemente dobrado, no qual duas folhas β, de seis fitas, envolvem duas α-hélices centrais. Há dois locais ativos na enzima que se encontram localizados na interface do dímero em lados opostos da proteína. A arquitetura do sítio catalítico de Ohr é composta por duas cisteínas, a peroxidática e a de resolução. A Cisteína peroxidática, localizada em uma das α-hélices centrais, tem por função a reação direta com hidroperóxidos, formando um ácido sulfênico. Este por sua vez se condensa com a Cisteína de resolução para formar uma ligação dissulfeto intramolecular. Além dos dois aminoácidos de Cys há também a presença de uma Arginina catalítica e um Glutamato que tem extrema importância na atividade da enzima Ohr, uma vez que ajudam a estabilizar a Cys em seu estado de tiolato através de interações polares, aumentando sua nucleofilicidade. O grupo carboxílico do glutamato catalítico orienta o grupo guanidínio da Arginina em direção a Cisteína, em uma configuração que parece ser ideal para a redução de hidroperóxidos orgânicos. Esse processo de estabilização descrito é o chamado estado fechado da tríade catalítica. No estado aberto ocorre o rompimento das interações e consequente mudança conformacional que acaba expondo o resíduo ao solvente, sendo esse último estado o mais propício para a redução da Ohr | ||
| - | |||
| - | [[Image:Captura_de_Tela_(6).png|left|430px]]<br /> | ||
| - | |||
| - | |||
==3D structures of Ohr== | ==3D structures of Ohr== | ||
[[Organic hydroperoxide resistance protein]] | [[Organic hydroperoxide resistance protein]] | ||
Revision as of 11:44, 7 December 2021
| |||||||||||