DD-transpeptidase (Hebrew)
From Proteopedia
(Difference between revisions)
| Line 27: | Line 27: | ||
===<div style="text-align:right;direction:rtl;">'''השפעת אנטיביוטיקה מסוג פניצילין על האנזים טרנספפטידאז'''</div>=== | ===<div style="text-align:right;direction:rtl;">'''השפעת אנטיביוטיקה מסוג פניצילין על האנזים טרנספפטידאז'''</div>=== | ||
<p dir='rtl'> | <p dir='rtl'> | ||
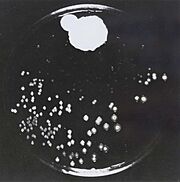
| + | [[Image:Penicillin fleming.jpg |thumb|left|היעדר מושבות של חיידקים בסביבת הפניציליום]] | ||
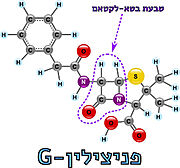
| + | [[Image:Beta-lactam2.jpg |thumb|left|מבנה טבעת הבטא-לקטאם]] | ||
[https://www.hamichlol.org.il/%D7%A4%D7%A0%D7%99%D7%A6%D7%99%D7%9C%D7%99%D7%9F פניצילין] הוא שם כולל לקבוצת חומרים אנטיביוטיים המעכבים את תהליך יצירת דופן התא על ידי עיכוב האנזים טרנספפטידאז. הפניצילין התגלה על ידי [https://davidson.weizmann.ac.il/online/sciencehistory/%D7%94%D7%99%D7%95%D7%9D-%D7%9C%D7%A4%D7%A0%D7%99-%D7%90%D7%9C%D7%9B%D7%A1%D7%A0%D7%93%D7%A8-%D7%A4%D7%9C%D7%9E%D7%99%D7%A0%D7%92 אלכסנדר פלמינג] בשנת 1928, ובהמשך פותחה הטכנולוגיה המאפשרת להפיק את החומר מפטריית העובש [https://www.familyhandyman.com/article/what-to-know-about-penicillium-mold/ פניציליום]. כיום ניתן לייצר גם פניצילינים סינתטיים-למחצה, כאשר המשותף לכל סוגי הפניצילינים הוא קיומה של מבנה טבעת הבטא-לקטם במולקולה; מבנה טבעתי המכיל 3 אטומי פחמן ואטום חנקן אחד (4) (5). | [https://www.hamichlol.org.il/%D7%A4%D7%A0%D7%99%D7%A6%D7%99%D7%9C%D7%99%D7%9F פניצילין] הוא שם כולל לקבוצת חומרים אנטיביוטיים המעכבים את תהליך יצירת דופן התא על ידי עיכוב האנזים טרנספפטידאז. הפניצילין התגלה על ידי [https://davidson.weizmann.ac.il/online/sciencehistory/%D7%94%D7%99%D7%95%D7%9D-%D7%9C%D7%A4%D7%A0%D7%99-%D7%90%D7%9C%D7%9B%D7%A1%D7%A0%D7%93%D7%A8-%D7%A4%D7%9C%D7%9E%D7%99%D7%A0%D7%92 אלכסנדר פלמינג] בשנת 1928, ובהמשך פותחה הטכנולוגיה המאפשרת להפיק את החומר מפטריית העובש [https://www.familyhandyman.com/article/what-to-know-about-penicillium-mold/ פניציליום]. כיום ניתן לייצר גם פניצילינים סינתטיים-למחצה, כאשר המשותף לכל סוגי הפניצילינים הוא קיומה של מבנה טבעת הבטא-לקטם במולקולה; מבנה טבעתי המכיל 3 אטומי פחמן ואטום חנקן אחד (4) (5). | ||
טבעת הבטא-לקטם דומה במבנה המרחבי ובהרכבה הכימי לצמד חומצות האמינו אלאנין המצויות בקצה הפפטיד בדופן הפפטידוגליקן. דמיון זה מאפשר לטבעת הבטא-לקטם להיקשר לחומצה האמינית סרין הממוקמת באתר הפעיל של האנזים טרנספפטידאז. עם זאת, בניגוד לתגובה המתרחשת בין הפפטיד לטרנספפטידאז המאפשרת את יצירת הקשר הצולב והתנתקות של האנזים לאחר מכן, טבעת הבטא-לקטם נפתחת ויוצרת קשר קוולנטי עם הח"א סרין שבאתר הפעיל, ובכך מעכבת את פעילות האנזים באופן [https://sites.google.com/site/enzymeinh/def/inh/rev בלתי הפיך]. מכיוון שטבעת הבטא-לקטם במולקולת הפניצילין נקשרת לאתר הפעיל באנזים, היא נחשבת ל[https://www.youtube.com/watch?v=sByPvdzUNsU&ab_channel=%D7%9E%D7%9B%D7%95%D7%9F%D7%93%D7%95%D7%99%D7%93%D7%A1%D7%95%D7%9F-%D7%A1%D7%A8%D7%98%D7%95%D7%A0%D7%99%D7%9E%D7%93%D7%A2 מעכב תחרותי] המתחרה עם הפפטידוגליקן (הסובסטראט) על הקישור לאתר הפעיל (6). | טבעת הבטא-לקטם דומה במבנה המרחבי ובהרכבה הכימי לצמד חומצות האמינו אלאנין המצויות בקצה הפפטיד בדופן הפפטידוגליקן. דמיון זה מאפשר לטבעת הבטא-לקטם להיקשר לחומצה האמינית סרין הממוקמת באתר הפעיל של האנזים טרנספפטידאז. עם זאת, בניגוד לתגובה המתרחשת בין הפפטיד לטרנספפטידאז המאפשרת את יצירת הקשר הצולב והתנתקות של האנזים לאחר מכן, טבעת הבטא-לקטם נפתחת ויוצרת קשר קוולנטי עם הח"א סרין שבאתר הפעיל, ובכך מעכבת את פעילות האנזים באופן [https://sites.google.com/site/enzymeinh/def/inh/rev בלתי הפיך]. מכיוון שטבעת הבטא-לקטם במולקולת הפניצילין נקשרת לאתר הפעיל באנזים, היא נחשבת ל[https://www.youtube.com/watch?v=sByPvdzUNsU&ab_channel=%D7%9E%D7%9B%D7%95%D7%9F%D7%93%D7%95%D7%99%D7%93%D7%A1%D7%95%D7%9F-%D7%A1%D7%A8%D7%98%D7%95%D7%A0%D7%99%D7%9E%D7%93%D7%A2 מעכב תחרותי] המתחרה עם הפפטידוגליקן (הסובסטראט) על הקישור לאתר הפעיל (6). | ||
| Line 32: | Line 34: | ||
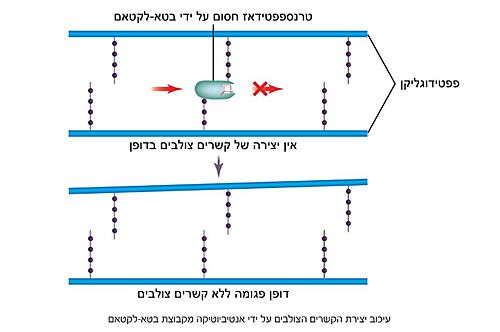
האנזים טרנספפטידאז פעיל בעיקר בזמן חלוקת תא החיידק, במהלכה דופן החיידקים שנוצרו נבנית מחדש. מסיבה זו, אנטיביוטיקה מסוג פניצילין משפיעה בעיקר על חיידקים מתחלקים, שכן בחיידקים שאינם מתחלקים הדופן כבר בנויה והאנזים טרנספפטידאז כמעט ואינו פעיל. בחשיפה לאנטיביוטיקה מסוג פניצילין לא נוצרים קשרים צולבים בדופן הפפטידוגליקן כתוצאה מעיכוב תחרותי ובלתי הפיך של האנזים טרנספפטידאז, ומבנה הדופן נפגם. היעדר הדופן הקשיחה גורר מצב שבו בסביבה [https://lo.cet.ac.il/player/?document=62ede947-12c3-45a1-bcad-639a9cae0368&language=he&sitekey=ebaghigh היפוטונית] - בה ריכוז המומסים מחוץ לתא קטן מריכוזם בתא (תמיסה מהולה) - מים יחדרו לתוך תא החיידק ויווצר לחץ על קרום התא עד להתפוצצותו. באופן זה גורמת החשיפה לפניצילין למוות של החיידקים הנמצאים בשלבי חלוקה בזמן החשיפה (7). | האנזים טרנספפטידאז פעיל בעיקר בזמן חלוקת תא החיידק, במהלכה דופן החיידקים שנוצרו נבנית מחדש. מסיבה זו, אנטיביוטיקה מסוג פניצילין משפיעה בעיקר על חיידקים מתחלקים, שכן בחיידקים שאינם מתחלקים הדופן כבר בנויה והאנזים טרנספפטידאז כמעט ואינו פעיל. בחשיפה לאנטיביוטיקה מסוג פניצילין לא נוצרים קשרים צולבים בדופן הפפטידוגליקן כתוצאה מעיכוב תחרותי ובלתי הפיך של האנזים טרנספפטידאז, ומבנה הדופן נפגם. היעדר הדופן הקשיחה גורר מצב שבו בסביבה [https://lo.cet.ac.il/player/?document=62ede947-12c3-45a1-bcad-639a9cae0368&language=he&sitekey=ebaghigh היפוטונית] - בה ריכוז המומסים מחוץ לתא קטן מריכוזם בתא (תמיסה מהולה) - מים יחדרו לתוך תא החיידק ויווצר לחץ על קרום התא עד להתפוצצותו. באופן זה גורמת החשיפה לפניצילין למוות של החיידקים הנמצאים בשלבי חלוקה בזמן החשיפה (7). | ||
</p> | </p> | ||
| + | [[Image:Penicillin activity.jpg|500 px]] | ||
| + | <br> | ||
This is a default text for your page '''DD-transpeptidase (Hebrew)'''. Click above on '''edit this page''' to modify. Be careful with the < and > signs. | This is a default text for your page '''DD-transpeptidase (Hebrew)'''. Click above on '''edit this page''' to modify. Be careful with the < and > signs. | ||
Revision as of 09:09, 11 January 2022
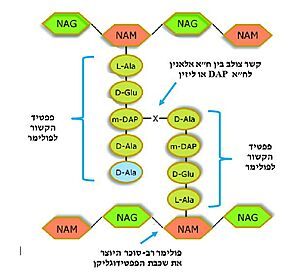
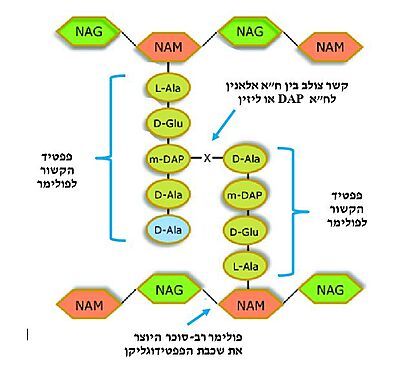
טרנספפטידאז
| |||||||||||
References
- ↑ Hanson, R. M., Prilusky, J., Renjian, Z., Nakane, T. and Sussman, J. L. (2013), JSmol and the Next-Generation Web-Based Representation of 3D Molecular Structure as Applied to Proteopedia. Isr. J. Chem., 53:207-216. doi:http://dx.doi.org/10.1002/ijch.201300024
- ↑ Herraez A. Biomolecules in the computer: Jmol to the rescue. Biochem Mol Biol Educ. 2006 Jul;34(4):255-61. doi: 10.1002/bmb.2006.494034042644. PMID:21638687 doi:10.1002/bmb.2006.494034042644