DD-transpeptidase (Hebrew)
From Proteopedia
(Difference between revisions)
| Line 20: | Line 20: | ||
[[Image:Peptide bond peptidoglycan.JPG|300 px|thumb|left|מבנה הפפטידוגליקן]] | [[Image:Peptide bond peptidoglycan.JPG|300 px|thumb|left|מבנה הפפטידוגליקן]] | ||
<p dir='rtl'> | <p dir='rtl'> | ||
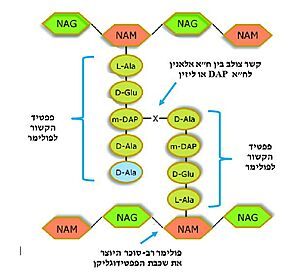
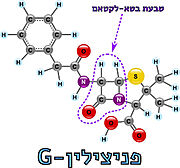
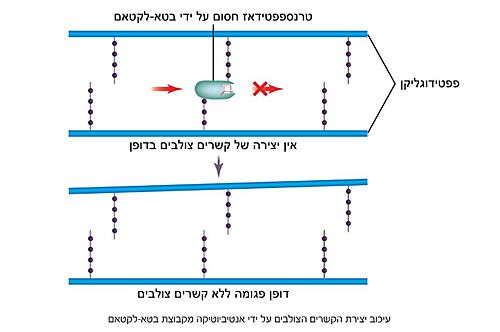
| - | האנזים טרנספפטידאז מעורב בבניית הדופן בתאי חיידקים, בזמן חלוקת התא. דופן התא היא מבנה קשיח המצוי מסביב לקרום תא החיידק, ובנוי ממולקולות פפטידוגליקן; פולימרים של רב-סוכר המחוברים בינהם בפפטידים קצרים. הפפטידים בין שכבות הפולימרים הרב-סוכריים נקשרים זה לזה בקשרים צולבים ומקנים לדופן מבנה תלת מימדי, יציב וקשיח. האנזים טרנספפטידאז אחראי על יצירת הקשרים הצולבים בין הפפטידים של שכבות הפפטידוגליקן | + | האנזים טרנספפטידאז מעורב בבניית הדופן בתאי חיידקים, בזמן חלוקת התא. דופן התא היא מבנה קשיח המצוי מסביב לקרום תא החיידק, ובנוי ממולקולות פפטידוגליקן; פולימרים של רב-סוכר המחוברים בינהם בפפטידים קצרים. הפפטידים בין שכבות הפולימרים הרב-סוכריים נקשרים זה לזה בקשרים צולבים ומקנים לדופן מבנה תלת מימדי, יציב וקשיח. האנזים טרנספפטידאז אחראי על יצירת הקשרים הצולבים בין הפפטידים של שכבות הפפטידוגליקן<ref name="WIEZMANN">[https://bioteach.org.il/%D7%A2%D7%9C%D7%95%D7%A0%D7%99%D7%9D-2002/%D7%AA%D7%95%D7%9B%D7%9F-%D7%A2%D7%99%D7%95%D7%A0%D7%99/%D7%A0%D7%95%D7%A9%D7%90%D7%99-%D7%94%D7%A2%D7%9E%D7%A7%D7%94-1/%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D/%D7%9E%D7%A7%D7%95%D7%A8%D7%95%D7%AA-%D7%9E%D7%99%D7%93%D7%A2-22/3573-%D7%A1%D7%A4%D7%A8-%D7%93%D7%99%D7%92%D7%99%D7%98%D7%9C%D7%99-%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D-2016 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016]</ref>. תגובה זו מתרחשת באתר הפעיל של האנזים, שבו חומצה אמינית סרין נקשרת לחומצה אמינית אלאנין הנמצאת בקצה הפפטיד בסובסטראט. האנזים מזרז את יצירת הקשר הפפטידי (סוג של [https://youtu.be/NgD9yHSJ29I?t=72 קשר קוולנטי] הנוצר בין חומצות אמינו) עם חומצת אמינו ליזין (בחיידקים גראם-חיוביים) או עם חומצת אמינו מסוג DAP (קיצור של: Diaminopimelic acid, בחיידקים גראם-חיוביים) הנמצאות בעמדה השלישית מהסוף בפפטיד המחובר לפולימר הסמוך. באופן זה נוצרים קשרים צולבים בין שכבות סמוכות בפפטידוגליקן, המקנים לדופן מבנה קשיח ויציב העמיד בפני לחץ אוסמוטי (3). |
[[Image:Cross link peptidoglycan.jpg|500 px|יצירת הקשר הפפטידי]] | [[Image:Cross link peptidoglycan.jpg|500 px|יצירת הקשר הפפטידי]] | ||
</p> | </p> | ||
Revision as of 07:43, 18 January 2022
טרנספפטידאז
| |||||||||||
ביבליוגרפיה
- ↑ PDB
- ↑ UNIPROT
- ↑ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution
- ↑ Wikipedia: DD-transpeptidase
- ↑ כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016