DD-transpeptidase (Hebrew)
From Proteopedia
(Difference between revisions)
| Line 11: | Line 11: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
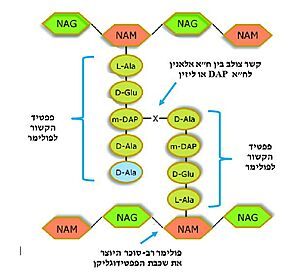
גודל [https://www.youtube.com/watch?v=aFwOfiPlSdc האנזים] טרנספפטידאז הוא 37.5 קילו דלתון והוא בנוי מ406 [https://www.youtube.com/watch?v=gpu2AUW4S5g&ab_channel=ComGeek חומצות אמינו]. בדגם שגובש ומוצג בערך זה יש את <scene name='89/898977/Amino_acids/2'>347 חומצות האמינו</scene> (בסצנה שלפניכם כל צבע מייצג יותר מחומצה אמינית אחת) המייצגות את החלבון הפעיל (עמדות 32-380) <ref name="PDB">[https://www.rcsb.org/structure/3PTE PDB]</ref>. המקטע שלא גובש כולל שרשרת פפטידית של 31 חומצות אמינו (1-31) בקצה ה-N טרמינלי של החלבון הנחתכת מהחלבון לאחר שהוא מגיע ליעדו בדופן התא, ועוד מקטע של 26 חומצות אמינו (381-406) הנחתך מהחלבון לאחר אקטיבציה<ref name="UNIPROT">[https://www.uniprot.org/uniprot/P15555 UNIPROT]</ref>. 60% מהחלבון מורכב משרשראות פוליפפטידיות בעלות [https://youtu.be/K2bCx3xQeJE?t=87 מבנה שניוני] (<scene name='89/898977/Secondary_structures/1'>סלילי אלפא ומשטחי בטא</scene>). האתר הפעיל של האנזים נוצר ע"י 4 חומצות אמינו בסיסיות ועוד 4 חומצות אמינו ארומטיות כאשר סרין במיקום 62 היא החומצה האמינית אשר קושרת אליה את הסובסטרט<ref name="PUBMED">[https://pubmed.ncbi.nlm.nih.gov/7490745/ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution]</ref>. | גודל [https://www.youtube.com/watch?v=aFwOfiPlSdc האנזים] טרנספפטידאז הוא 37.5 קילו דלתון והוא בנוי מ406 [https://www.youtube.com/watch?v=gpu2AUW4S5g&ab_channel=ComGeek חומצות אמינו]. בדגם שגובש ומוצג בערך זה יש את <scene name='89/898977/Amino_acids/2'>347 חומצות האמינו</scene> (בסצנה שלפניכם כל צבע מייצג יותר מחומצה אמינית אחת) המייצגות את החלבון הפעיל (עמדות 32-380) <ref name="PDB">[https://www.rcsb.org/structure/3PTE PDB]</ref>. המקטע שלא גובש כולל שרשרת פפטידית של 31 חומצות אמינו (1-31) בקצה ה-N טרמינלי של החלבון הנחתכת מהחלבון לאחר שהוא מגיע ליעדו בדופן התא, ועוד מקטע של 26 חומצות אמינו (381-406) הנחתך מהחלבון לאחר אקטיבציה<ref name="UNIPROT">[https://www.uniprot.org/uniprot/P15555 UNIPROT]</ref>. 60% מהחלבון מורכב משרשראות פוליפפטידיות בעלות [https://youtu.be/K2bCx3xQeJE?t=87 מבנה שניוני] (<scene name='89/898977/Secondary_structures/1'>סלילי אלפא ומשטחי בטא</scene>). האתר הפעיל של האנזים נוצר ע"י 4 חומצות אמינו בסיסיות ועוד 4 חומצות אמינו ארומטיות כאשר סרין במיקום 62 היא החומצה האמינית אשר קושרת אליה את הסובסטרט<ref name="PUBMED">[https://pubmed.ncbi.nlm.nih.gov/7490745/ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution]</ref>. | ||
| - | </p> | + | </p> |
<br> | <br> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
באתר הפעיל יש <scene name='89/898977/Conserved_aa/2'> 8 חומצות אמינו </scene> הנמצאו שמורות אבולוציונית בכל סוגי האנזימים ממשפחת [https://iw.strephonsays.com/protease-and-vs-peptidase-4913 הפפטידאזות]. חומצות אמינו אלו ממוקמות בשלושה אזורים שונים באתר הפעיל והן יוצרות את <scene name='89/898977/Catalytic_pocket/1'>הכיס הקטליטי</scene> של האנזים. <scene name='89/898977/Active_site/3'>סרין 62 וליזין 65 </scene> אחראיות לתגובה הכימית עם הסובסטראט<ref name="WIKI1">[https://en.wikipedia.org/wiki/DD-transpeptidase Wikipedia: DD-transpeptidase]</ref>, ושתי הקבוצות: טירוזין159-סרין160-אספרגין161, היסטידין298-תראונין299-גליצין300, הן חלק מ<scene name='89/898977/Binding_sites/1'>אתרי הקישור לסובסטרט</scene>. | באתר הפעיל יש <scene name='89/898977/Conserved_aa/2'> 8 חומצות אמינו </scene> הנמצאו שמורות אבולוציונית בכל סוגי האנזימים ממשפחת [https://iw.strephonsays.com/protease-and-vs-peptidase-4913 הפפטידאזות]. חומצות אמינו אלו ממוקמות בשלושה אזורים שונים באתר הפעיל והן יוצרות את <scene name='89/898977/Catalytic_pocket/1'>הכיס הקטליטי</scene> של האנזים. <scene name='89/898977/Active_site/3'>סרין 62 וליזין 65 </scene> אחראיות לתגובה הכימית עם הסובסטראט<ref name="WIKI1">[https://en.wikipedia.org/wiki/DD-transpeptidase Wikipedia: DD-transpeptidase]</ref>, ושתי הקבוצות: טירוזין159-סרין160-אספרגין161, היסטידין298-תראונין299-גליצין300, הן חלק מ<scene name='89/898977/Binding_sites/1'>אתרי הקישור לסובסטרט</scene>. | ||
| + | </p> | ||
| + | <p dir='rtl'> | ||
| + | בנוסף, חלבון זה מכיל 2 חומצות אמינו מסוג ציסטאין, המכילות אטום גופרית בשייר שלהן. בין 2 אטומי גופרית אלו נוצרים קשרי S-S, המכונים גם [https://he.wikipedia.org/wiki/%D7%A7%D7%A9%D7%A8_%D7%93%D7%99%D7%A1%D7%95%D7%9C%D7%A4%D7%99%D7%93%D7%99 קשרים דיסולפידים] או קשרי גופרית, והם תורמים רבות לייצוב המבנה השלישוני של החלבון<ref name="WIKI4">[https://he.wikipedia.org/wiki/%D7%A6%D7%99%D7%A1%D7%98%D7%90%D7%99%D7%9F ויקיפדיה: ציסטאין]</ref>. מיקומו של הקשר הדיסולפידי בחלבון מסומן בקו צהוב וניתן לראותו בסצנה המתארת את אתרי הקישור לסובסטרט. | ||
</p> | </p> | ||
Revision as of 11:50, 30 January 2022
טרנספפטידאז
| |||||||||||
קבצים מצורפים
ביבליוגרפיה
- ↑ PDB
- ↑ UNIPROT
- ↑ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution
- ↑ Wikipedia: DD-transpeptidase
- ↑ ויקיפדיה: ציסטאין
- ↑ 6.0 6.1 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016
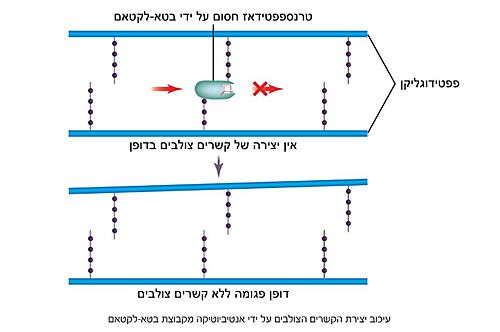
- ↑ 7.0 7.1 A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins
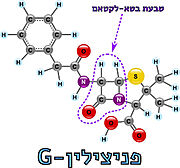
- ↑ ויקיפדיה: פניצילין
- ↑ ויקיפדיה: לקטאם