2cf4 (Italian)
From Proteopedia
m |
|||
| Line 1: | Line 1: | ||
| - | ==This is a placeholder== | ||
| - | This is a placeholder text to help you get started in | ||
| - | placing a Jmol applet on your page. At any time, click | ||
| - | "Show Preview" at the bottom of this page to see how it goes. | ||
| - | |||
| - | Replace the PDB id (use lowercase!) after the STRUCTURE_ and after PDB= to load | ||
| - | and display another structure. | ||
| - | |||
{{STRUCTURE_2cf4 | PDB=2cf4 | SCENE= }} | {{STRUCTURE_2cf4 | PDB=2cf4 | SCENE= }} | ||
| Line 21: | Line 13: | ||
===''PYROCOCCUS HORIKOSHII'' TET1 PEPTIDASE PUO ASSEMBLARE IN UN TETRAEDRO O UN GRANDE OTTAEDRO=== | ===''PYROCOCCUS HORIKOSHII'' TET1 PEPTIDASE PUO ASSEMBLARE IN UN TETRAEDRO O UN GRANDE OTTAEDRO=== | ||
| - | La proteolisi cellulare usa grande peptidasi oligomeriche che giocano ruoli chiave nella regolazione di molti processi cellulari. La peptidase TET1, cobalto-attivata, dal Archaea ipertermofilo ''Pyrococcus horikoshii'' (''Ph''TET1) si assembla come un tetraedro di 12 sub-unità e come una particella ottaedrale di 24 sub-unità. Ambo le strutture quaternarie furono risolte combinando cristallografia ai raggi X e dati di crio-microscopia elettronica. L'organizzazione interna delle particelle di ''Ph''TET1 rivela sistemi estremamente stesso-compartiti fatti di reti di canali di accesso, estese da grande camere catalitiche. I due edifici mostrano una attività di aminopeptidase, e le loro organizzazioni indicano meccanismi di navigazione di sostrato | + | La proteolisi cellulare usa grande peptidasi oligomeriche che giocano ruoli chiave nella regolazione di molti processi cellulari. La peptidase TET1, cobalto-attivata, dal Archaea ipertermofilo ''Pyrococcus horikoshii'' (''Ph''TET1) si assembla come un tetraedro di 12 sub-unità e come una particella ottaedrale di 24 sub-unità. Ambo le strutture quaternarie furono risolte combinando cristallografia ai raggi X e dati di crio-microscopia elettronica. L'organizzazione interna delle particelle di ''Ph''TET1 rivela sistemi estremamente stesso-compartiti fatti di reti di canali di accesso, estese da grande camere catalitiche. I due edifici mostrano una attività di aminopeptidase, e le loro organizzazioni indicano meccanismi di navigazione di sostrato diversi da quelli descritti negli altri grandi complessi di peptidase. Comparato col tetraedro, l'ottaedro forma una struttura cavo e più allargata, rappresentando un tipo nuovo di complesso di peptidase gigante. ''Ph''TET1 assembla in due strutture quaternarie diverse a causa di contatti quasi-equivalenti che prima sono stati identificati solamente in capsidi di virus. |
Riassunto tradotto di MEDLINE®/PubMed®, una banca dati del U.S. National Library of Medicine. | Riassunto tradotto di MEDLINE®/PubMed®, una banca dati del U.S. National Library of Medicine. | ||
Revision as of 21:26, 23 November 2009
| |||||||
| 2cf4, resolution 3.08Å () | |||||||
|---|---|---|---|---|---|---|---|
| Ligands: | |||||||
| Non-Standard Residues: | |||||||
| |||||||
| |||||||
| Resources: | FirstGlance, OCA, RCSB, PDBsum | ||||||
| Coordinates: | save as pdb, mmCIF, xml | ||||||
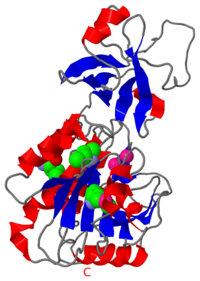
PYROCOCCUS HORIKOSHII TET1 PEPTIDASE PUO ASSEMBLARE IN UN TETRAEDRO O UN GRANDE OTTAEDRO
La proteolisi cellulare usa grande peptidasi oligomeriche che giocano ruoli chiave nella regolazione di molti processi cellulari. La peptidase TET1, cobalto-attivata, dal Archaea ipertermofilo Pyrococcus horikoshii (PhTET1) si assembla come un tetraedro di 12 sub-unità e come una particella ottaedrale di 24 sub-unità. Ambo le strutture quaternarie furono risolte combinando cristallografia ai raggi X e dati di crio-microscopia elettronica. L'organizzazione interna delle particelle di PhTET1 rivela sistemi estremamente stesso-compartiti fatti di reti di canali di accesso, estese da grande camere catalitiche. I due edifici mostrano una attività di aminopeptidase, e le loro organizzazioni indicano meccanismi di navigazione di sostrato diversi da quelli descritti negli altri grandi complessi di peptidase. Comparato col tetraedro, l'ottaedro forma una struttura cavo e più allargata, rappresentando un tipo nuovo di complesso di peptidase gigante. PhTET1 assembla in due strutture quaternarie diverse a causa di contatti quasi-equivalenti che prima sono stati identificati solamente in capsidi di virus.
Riassunto tradotto di MEDLINE®/PubMed®, una banca dati del U.S. National Library of Medicine.
A proposito di questa Struttura
2CF4 è una struttura a 1 catena di sequenza di Pyrococcus horikoshii. Dalle informazioni cristallografiche completi sono disponibili su OCA.
Riferimento
- Schoehn G, Vellieux FM, Asuncion Dura M, Receveur-Brechot V, Fabry CM, Ruigrok RW, Ebel C, Roussel A, Franzetti B. An archaeal peptidase assembles into two different quaternary structures: A tetrahedron and a giant octahedron. J Biol Chem. 2006 Nov 24;281(47):36327-37. Epub 2006 Sep 14. PMID:16973604 doi:10.1074/jbc.M604417200
Page seeded by OCA on Mon Feb 16 19:51:37 2009