Aricept Complexed with Acetylcholinesterase (Spanish)
From Proteopedia
m |
(better Spanish) |
||
| Line 3: | Line 3: | ||
{{STRUCTURE_1eve| PDB=1eve | SCENE=Main_Page/E2020_in_ache_spinning/1 }} | {{STRUCTURE_1eve| PDB=1eve | SCENE=Main_Page/E2020_in_ache_spinning/1 }} | ||
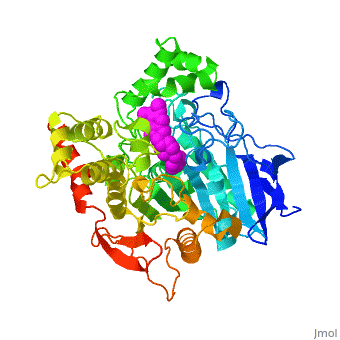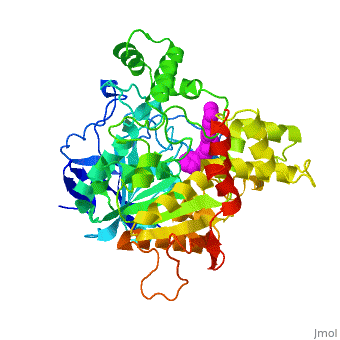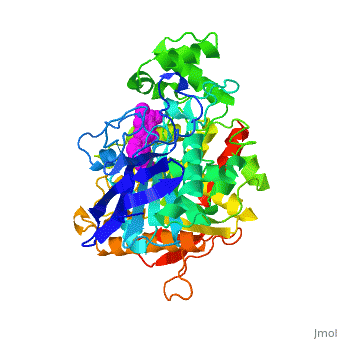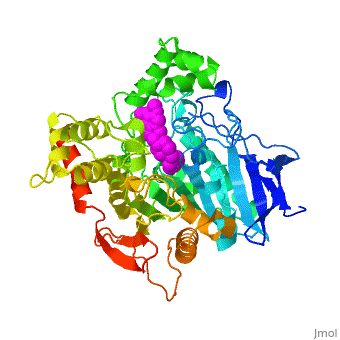
| - | '''Estructura tridimensional de | + | '''Estructura tridimensional de Aricept, una droga contra la enfermedad de Alzheimer, complejada con la acetilcolinesterasa''' |
| - | ( | + | (véase tambien [[AChE bivalent inhibitors (Part II)|inhibidores bivalentes de AChE, parte II]]) |
==Antecedentes== | ==Antecedentes== | ||
| - | Varios inhibidores de la colinesterasa se utilizan para el tratamiento sintomático de la enfermedad de Alzheimer o se encuentran en estado avanzado de ensayo clínico. '''E2020''', comercializado como '''Aricept''', | + | Varios inhibidores de la colinesterasa se utilizan para el tratamiento sintomático de la enfermedad de Alzheimer o se encuentran en estado avanzado de ensayo clínico. '''E2020''', comercializado como '''Aricept''', pertenece a la numerosa familia de la N-benzilpiperidina, basada en inhibidores de la [[acetylcholinesterase|acetilcolinesterasa]] (AChE). '''Aricept''' ha sido desarrollado, sintetizado y evaluado por la Compañía Eisai en el Japón. Estos inhibidores fueron diseñados a partir de estudios QSAR, antes de conocerse la estructura 3D de la AChE de ''Torpedo californica'' (''Tc''AChE) ([[1ea5]]). Con este inhibidor se mejora significativamente el rendimiento en animales de hipofunción colinérgica y tiene una alta afinidad por la AChE, uniéndose a la AChE tanto de anguila eléctrica como de ratón en el orden nanomolar. |
{{Clear}} | {{Clear}} | ||
| Line 13: | Line 13: | ||
==Resultados== | ==Resultados== | ||
| - | La estructura de rayos X | + | La estructura obtenida por difracción de rayos X para el complejo E2020-''Tc''AChE pone de manifiesto que el E2020 tiene una orientación <scene name='1eve/E2020_close_up_with_84_279/13'>única</scene> a lo largo de la hendidura del sitio activo, extendiéndose desde el sub-sitio aniónico (<scene name='1eve/E2020_close_up_with_84lbld/7'>W84</scene>) del sitio activo, abajo, hasta el sitio aniónico periférico (<scene name='1eve/E2020_close_up_with_84_279lbld/5'>cerca W279</scene>), arriba, a través de interacciones de apilamiento de residuos aromáticos conservados. E2020, sin embargo, no interacciona directamente con la tríada catalítica ni con el 'hueco del oxianión', sino sólo <scene name='1eve/E20_interactionshown/8'>en forma indirecta</scene> a través de moléculas del disolvente. |
==Conclusiones== | ==Conclusiones== | ||
| - | La estructura de | + | La estructura obtenida con difracción de rayos X muestra, a posteriori, que el diseño de E2020 ha aprovechado varias características importantes de la hendidura del sitio activo de la AChE, produciendo una droga con alta afinidad y alta selectividad, comparada con la butirilcolinesterasa (BChE). Asimismo, delimita huecos dentro de la hendidura que no están ocupados por E2020 y podrían proporcionar sitios para una modificación potencial de E2020 de cara a producir drogas con mejores capacidades farmacológicas. |
| - | ==Acerca de esta | + | ==Acerca de esta estructura== |
| - | 1EVE es | + | 1EVE es una [http://en.wikipedia.org/wiki/Protein proteína] de una sola cadena, procedente de [http://en.wikipedia.org/wiki/Torpedo_californica ''Torpedo californica''], con NAG y E20 como [http://en.wikipedia.org/wiki/ligands ligandos]. Es activa como [[Acetylcholinesterase | acetilcolinesterasa]], con el número [http://www.brenda-enzymes.info/php/result_flat.php4?ecno=3.1.1.7 EC 3.1.1.7]. Hay información cristalográfica completa en [http://ispc.weizmann.ac.il/oca-bin/ocashort?id=1EVE OCA]. |
==Referencias== | ==Referencias== | ||
<ref group=xtra>PMID:10368299</ref><references group=xtra/> | <ref group=xtra>PMID:10368299</ref><references group=xtra/> | ||
| - | * | + | * Véase también [[1eve]] (English), [[1eve (Chinese)]], [[1eve (French)]], [[1eve (Italian)]], [[1eve (Arabic)]], [[1eve (Russian)]], & [[1eve (Turkish)]]. |
[[Category: Acetylcholinesterase]] | [[Category: Acetylcholinesterase]] | ||
Revision as of 15:02, 5 March 2010
| |||||||||
| 1eve, resolution 2.50Å () | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ligands: | , | ||||||||
| Activity: | Acetylcholinesterase, with EC number 3.1.1.7 | ||||||||
| |||||||||
| |||||||||
| Resources: | FirstGlance, OCA, RCSB, PDBsum | ||||||||
| Coordinates: | save as pdb, mmCIF, xml | ||||||||
Estructura tridimensional de Aricept, una droga contra la enfermedad de Alzheimer, complejada con la acetilcolinesterasa
(véase tambien inhibidores bivalentes de AChE, parte II)
Contents |
Antecedentes
Varios inhibidores de la colinesterasa se utilizan para el tratamiento sintomático de la enfermedad de Alzheimer o se encuentran en estado avanzado de ensayo clínico. E2020, comercializado como Aricept, pertenece a la numerosa familia de la N-benzilpiperidina, basada en inhibidores de la acetilcolinesterasa (AChE). Aricept ha sido desarrollado, sintetizado y evaluado por la Compañía Eisai en el Japón. Estos inhibidores fueron diseñados a partir de estudios QSAR, antes de conocerse la estructura 3D de la AChE de Torpedo californica (TcAChE) (1ea5). Con este inhibidor se mejora significativamente el rendimiento en animales de hipofunción colinérgica y tiene una alta afinidad por la AChE, uniéndose a la AChE tanto de anguila eléctrica como de ratón en el orden nanomolar.
|
Resultados
La estructura obtenida por difracción de rayos X para el complejo E2020-TcAChE pone de manifiesto que el E2020 tiene una orientación a lo largo de la hendidura del sitio activo, extendiéndose desde el sub-sitio aniónico () del sitio activo, abajo, hasta el sitio aniónico periférico (), arriba, a través de interacciones de apilamiento de residuos aromáticos conservados. E2020, sin embargo, no interacciona directamente con la tríada catalítica ni con el 'hueco del oxianión', sino sólo a través de moléculas del disolvente.
Conclusiones
La estructura obtenida con difracción de rayos X muestra, a posteriori, que el diseño de E2020 ha aprovechado varias características importantes de la hendidura del sitio activo de la AChE, produciendo una droga con alta afinidad y alta selectividad, comparada con la butirilcolinesterasa (BChE). Asimismo, delimita huecos dentro de la hendidura que no están ocupados por E2020 y podrían proporcionar sitios para una modificación potencial de E2020 de cara a producir drogas con mejores capacidades farmacológicas.
Acerca de esta estructura
1EVE es una proteína de una sola cadena, procedente de Torpedo californica, con NAG y E20 como ligandos. Es activa como acetilcolinesterasa, con el número EC 3.1.1.7. Hay información cristalográfica completa en OCA.
Referencias
- Kryger G, Silman I, Sussman JL. Structure of acetylcholinesterase complexed with E2020 (Aricept): implications for the design of new anti-Alzheimer drugs. Structure. 1999 Mar 15;7(3):297-307. PMID:10368299
- Véase también 1eve (English), 1eve (Chinese), 1eve (French), 1eve (Italian), 1eve (Arabic), 1eve (Russian), & 1eve (Turkish).
Proteopedia Page Contributors and Editors (what is this?)
Jaime Prilusky, Joel L. Sussman, Fred Vellieux, Alexander Berchansky, Angel Herraez