Thrombin (hebrew)
From Proteopedia
| Line 19: | Line 19: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | + | החלבון תרומבין הוא גליקופרוטאיד. המסה שלו היא 36000 גרם/מול. החלבון בנוי <scene name='Thrombin_(hebrew)/Helix/2'>מסלילי אלפא</scene> ו<scene name='Thrombin_(hebrew)/Sheet/2'>משטחי בטא</scene>. החלבון בנוי משתי שרשראות פוליפפטידיות עם קשר גופרי ביניהן. | |
בשרשרת A נמצא האתר הפעיל של האנזים ורצף של חומצות אמינו הומולוגי למבנה של טריפסין וכימוטריפסין. תרומבין קיים בטבע בכמה צורות פעילות שנבדלות ביניהן במבנה שרשרת A. | בשרשרת A נמצא האתר הפעיל של האנזים ורצף של חומצות אמינו הומולוגי למבנה של טריפסין וכימוטריפסין. תרומבין קיים בטבע בכמה צורות פעילות שנבדלות ביניהן במבנה שרשרת A. | ||
| Line 71: | Line 71: | ||
</p> | </p> | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | 2. '''עודף קרישת דם''' - כאשר נפגעת הבקרה על תהליך קרישת הדם, הקריש שנוצר עלול להתנתק עם הזמן ממקומו | + | 2. '''עודף קרישת דם''' - כאשר נפגעת הבקרה על תהליך קרישת הדם, הקריש שנוצר עלול להתנתק עם הזמן ממקומו ולנוע בזרם הדם עד שיגיע לכלי דם צר. שם הוא עלול לחסום את מעבר הדם ולגרום לחסימה שתוביל לאוטם שריר הלב או לשבץ מוחי. קרישה מוגברת עלולה להיגרם גם מפגיעה בדופן כלי הדם, עקב [http://lib.cet.ac.il/pages/item.asp?item=7246&kwd=5627 טרשת עורקים] או כוויות, דבר הגורם לשפעול טסיות הדם באזור הפגוע וליצירת קריש דם. גורמים נוספים העלולים להוביל לקרישת יתר הם שכיבה ממושכת, טיסה ארוכה ללא תנועה, ניתוח כירורגי, עישון ותרופות. |
</p> | </p> | ||
Revision as of 04:59, 17 June 2011
תרומבין
החלבון תרומבין הוא אנזים בעל תפקיד חשוב במנגנון קרישת דם אצל בעלי חיים ובני אדם. התרומבין הוא אנזים מסוג סרין פרוטאז, הוא חותך את חלבון הסובסטראט שלו באמצעות החומצה האמינית סרין שנמצאת באתר הפעיל שלו. בסוף שלב קרישת הדם, התרומבין מפרק את חלבון הפיברינוגן והופך אותו מחלבון מסיס לחלבון לא מסיס הנקרא פיברין. לאחר החיתוך נוצרים ברקמה הנגועה סיבי פיברין היוצרים מבנה של שתי וערב הסוגר על מקום הפגיעה וגורמים להפסקת אבדן הדם. התרומבין אינו מצוי בדם באופן תמידי אלא נוצר על פי הצורך מפרותרומבין. הפרותרומבין נוצר בכבד מויטמין K. בכדי שהפרותרומבין יהפוך לתרומבין יש צורך בנוכחות יוני סידן ואנזים המכונה תרומבופלסטין.
|
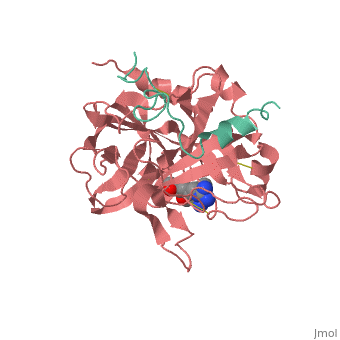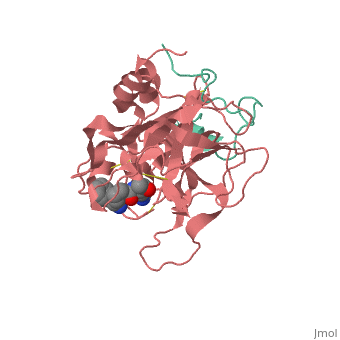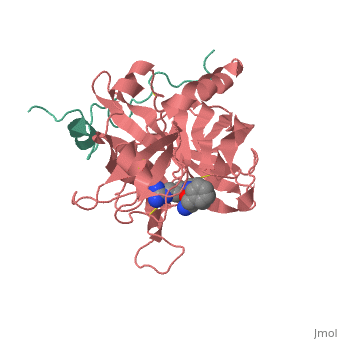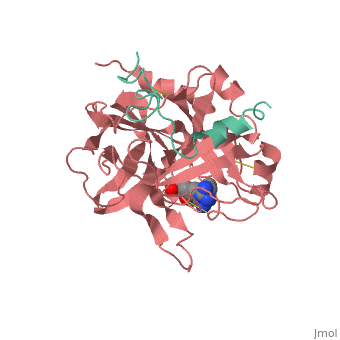
החלבון תרומבין הוא גליקופרוטאיד. המסה שלו היא 36000 גרם/מול. החלבון בנוי ו. החלבון בנוי משתי שרשראות פוליפפטידיות עם קשר גופרי ביניהן. בשרשרת A נמצא האתר הפעיל של האנזים ורצף של חומצות אמינו הומולוגי למבנה של טריפסין וכימוטריפסין. תרומבין קיים בטבע בכמה צורות פעילות שנבדלות ביניהן במבנה שרשרת A. לחלבון : (שרשרת A צבועה ירוק ושרשרת B צבועה ורוד).
לתרומבין כיס הידרופובי המאפשר לו ספציפיות בקישור מקרומולקולות כמו הירודין ופיברינוגן. חומצה האמינית היא אחת מהחומצות אמינו ב של החלבון. ה (חומצות האמינו המצויות באתר הפעיל צבועות בצבע כחול) של התרומבין ממוקם בתוך כיס הידרובי. לתרומבין יש אתר קישור, בו חומצות האמינו (צבועות באדום) נקשרות אל ההירודין ופיברינוגן. חומצות האמינו ב (צבועות בכחול) מאפשרות קישור ספציפי לליגנד (צבוע באדום).
הקריסטלוגרפיה של חלבון התרומבין נעשתה כאשר הוא קשור לליגנד לא טבעי. ה (צבוע בצבע אדום) נקשר אל החלבון באתר הפעיל שלו. חומצות האמינו (צבועות בשחור) קושרות את המתיל CH2 של הליגנד.
ניתן לחלק את המחלות הקשורות לקרישת דם לשתי קבוצות עיקריות:
1. העדר קרישת דם - יכול לנבוע מפגיעה בכל אחד מהחלבונים (פקטורים) במנגנון קרישת הדם. בחלק מהמחלות נפגע ייצור קרישי הדם, דבר הגורם לדממת (לדוגמא מחלת המופיליה). גם מספר נמוך מדי של טסיות דם עלול להוביל למצב של בעיה בקרישת דם, הדבר עלול לגרום לדימומים פנימיים. בעיות בתפקוד הכבד כגון דלקת כבד עלולים להוביל למחסור ב ויטמין K ולחוסר פעילות תקינה של מנגנון הקרישה.
2. עודף קרישת דם - כאשר נפגעת הבקרה על תהליך קרישת הדם, הקריש שנוצר עלול להתנתק עם הזמן ממקומו ולנוע בזרם הדם עד שיגיע לכלי דם צר. שם הוא עלול לחסום את מעבר הדם ולגרום לחסימה שתוביל לאוטם שריר הלב או לשבץ מוחי. קרישה מוגברת עלולה להיגרם גם מפגיעה בדופן כלי הדם, עקב טרשת עורקים או כוויות, דבר הגורם לשפעול טסיות הדם באזור הפגוע וליצירת קריש דם. גורמים נוספים העלולים להוביל לקרישת יתר הם שכיבה ממושכת, טיסה ארוכה ללא תנועה, ניתוח כירורגי, עישון ותרופות.
Proteopedia Page Contributors and Editors (what is this?)
Revital Ben Dvash, Yael Guri, Michal Harel, Shany Doron, Sigal Gadker