Sandbox קרטין
From Proteopedia
| Line 1: | Line 1: | ||
<div dir='rtl'> | <div dir='rtl'> | ||
| + | <Structure load='3tnu' size='300' frame='true' align='left' caption='מבנה של אזור 2B בשתי מולקולות של קרטין מלופפות ביחד' scene='Insert optional scene name here' /> | ||
| + | חלבונים מסוג קרטין יוצרים מבנים סיביים בתוך תאי אפיתל. סיבים שנוצרים ע"י קרטינים נקראים פילמנטים בינוניים, באנגלית: intermediate filaments. מערכת זו הינה אחת משלוש מערכות של שלד תאי (ציטוסקלטון) שנמצאות ברוב התאים. שתי המערכות האחרות הן: מיקרופילמנטים המורכבים מחלבון אקטין ומיקרוטובולים המורכבים מחלבון מסוג טובולין. | ||
| - | + | בעוד שמיקרופילמנטים ומיקרוטובולים מורכבים מחלבונים כדוריים (globular), פילמנטים בינוניים מורכבים מחלבונים סיביים (fibrous) בעלי מבנה סיבי ארוך שאינם כדוריים. | |
| - | + | בנוסף לתאי אפיתל, קרטינים הם מרכיבים מרכזיים בשערות ובצמר. בשערה, קרטינים יוצרים את הציר המרכזי לאורך השערה. מבנה סיבים אלה מחוזק על ידי חלבונים אחרים שנקראים בשם "חלבונים שקשורים לקרטין" - באנגלית: keratin associated proteins. חלבונים אלה נקשרים לקרטינים בקשרי דיסולפידי לחיזוק המבנה הסיבי. | |
| - | == | + | ==מבנה ראשוני של חלבונים מסוג קרטין== |
| - | + | ביונקים ישנה משפחה גדולה של חלבונים מסוג קרטין שמתבטאים באופן ספציפי בתאים שונים. חלבונים אלה מראים שונות בגודלם ומשקלם המולקולרי נע בטווח בין 50 עד לכ-70 קילודלטון. | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | המבנה הראשוני של קרטין נקבע לראשונה ע"י חוקר ישראלי שעבד באוניברסיטת שיקגו. | |
| + | <ref name="PMID6186381">PMID:6186381</ref> <ref name="PMID6191871">PMID:6191871</ref> | ||
| + | עבודות אלה חשפו כי ישנם שני סוגים של קרטינים שנקראו בשם קרטין מסוג I וקרטין מסוג II, באנגלית: Type I and Type II. | ||
| - | + | קביעת רצף הגנום האנושי חשפה כי בבן אדם ישנם 54 גנים שמקודדים לקרטינים. | |
| + | <ref name="PMID16831889">PMID:16831889</ref><ref name="PMID15085952">PMID:15085952</ref> | ||
| + | גנים אלה ממוקמים באופן מרוכז בשני כרומוזומים. מיקום של גנים הומולוגיים בשכנות מעיד על כך שגנים אלה נוצרו כתוצאה של דופליקציה של גנים. כל הקרטינים הומולוגיים זה לזה ברצף השיירים שלהם. ניתן לסווג את הקרטינים לשתי קבוצות, סוג I ו-II בהתאם להגדרה המקורית של חנוקוגלו. לרוב, קרטינים מסוג I הם קטנים יותר וחומציים. לעומתם קרטינים מסוג II הם ארוכים יותר ובסיסיים. | ||
| - | + | אם קרטינים הם הומולוגיים ברצפם אז נשאלת השאלה, מה הם ההבדלים בין הקרטינים השונים? | |
| - | + | קביעת רצפם של שני סוגי הקרטינים חשפה כי בחלבונים אלה הומולוגיה עיקרית נראית בחלק המרכזי של החלבונים שהוא באורך של כ-300 שיירים. לעומת חלק מרכזי זה, קצוות אמינו וקרבוקסי של הקרטינים מראים שונות גדולה. ההבדלים בגודלם של הקרטינים נובעים משונות באורכם של קצוות אמינו וקרבוקסי שנקראים בהתאמה הראש והזנב של מולקולת קרטין. | |
| - | + | ==מבנה שניוני של קרטנים== | |
| - | + | אנליזת הרצף של שני סוגי הקרטינים הביאה למסקנה כי בחלבונים אלה ישנם ארבעה קטעים מרכזיים בעלי מבנה שניוני סליל אלפא. | |
| + | <ref name="PMID6186381" /> <ref name="PMID6191871" /> | ||
| + | כפי שנראה באיור להלן, ארבעה קטעים אלו נקראים: 1A 1B 2A 2B. קצוות אמינו וקרבוקסי של קרטינים הם שונים מאד הן באורך והן ברצף שלהם. והמבנה שלהם אינו ידוע. | ||
| + | [[Image:Keratin-secondary-structure.png]] | ||
| - | + | קביעת מבנה שלישוני של חלבון דורשת יצירת גביש של חלבון שניתן לקבוע את מבנהו בשיטת קריסטלוגרפיית קרני X. בגלל הנטייה של קרטינים ליצור סיבים באופן ספונטני, לא ניתן ליצור גבישים של קרטינים שלמים. לכן עד כה לא נקבע מבנה שלישוני של אלפא קרטין שלם. אבל בעזרת שיטות הנדסה גנטית, חוקרים יצרו קטעי גנים שמקודדים לאזור 2B- הקטע באורך של כ-90 שיירים שנמצא בקונפורמציה של סליל אלפא בהתאם למודל לעיל. קביעת מבנה גבישי של קטע זה הוכיח שאכן קטע זה הוא במבנה סליל אלפא. | |
| - | + | <ref name="PMID22705788">PMID:22705788</ref> | |
| - | + | ==מבנה שלישוני ורביעוני של קרטינים== | |
| - | + | ישנן מספר ראיות שסיבי אלפא קרטין מורכבים ממבנה בסיסי של דימר של קרטין מסוג I עם קרטין מסוג II. שני חלבונים אלה מלופפים ביחד בקטעים בעלי מבנה סליל אלפא ויוצרים מבנה שנקרא מבנה סלילי מלופף ( coiled coil). קביעת מבנה גבישי של קטע 2B של קרטין הוכיחה שאכן שני הקרטינים בקטעים אלה נמצאים במבנה מלופף. | |
| - | <ref | + | <ref name="PMID22705788" /> |
| - | + | במבנה רביעוני של קרטינים, לכל מולקולת קרטין ישנם שני סוגי אינטראקציות: 1. דימר של קרטין נצמד לעוד דימר של קרטין ליצור טטרמר שמורכב מארבע מולקולות של קרטין. 2. כל מולקולת קרטין נקשר בקצהו לקרטין אחר ליצור שרשרת ארוכה של סיבי קרטין. | |
| + | <ref>PMID:19766969</ref> | ||
| - | + | ==הקשרים במבנה מלופף של סליל אלפאcoiled coil== | |
| - | == | + | <Structure load='3tnu' size='400' frame='true' align='left' caption='Insert caption here' scene='Insert optional scene name here' /> |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | שאלה מרכזית לגבי מבנה רביעוני של אלפא קרטינים | + | שאלה מרכזית אחת לגבי מבנה רביעוני של אלפא קרטינים היא איזה סוג של קשר מחזיק את סלילי הקרטין ביחד במבנה מלופף. עוד לפני שפענוח מבנה גבישי של אלפא קרטינים, על בסיס מודלים של מבנה מלופף coiled coil , חוקרים נבאו כי במבנה מלופף סלילי אלפא נקשרים זו לזה בעזרת קשרים הידרופוביים בין שיירים אפולריים. במבנה של סליל אלפא ישנם 3.6 שיירים בכל סיבוב של סליל. בגלל מחזוריות זו, ישנו גם מחזוריות בנקודות מגע בין שני סלילים מלופפים. מחזוריות זו נראה במיקומם של שיירים אפולריים במקומות A ו-D במחזור שנקרא Heptad repeat של שבעה שיירים שמיוצגים באותיות ABCDEFG . |
| + | <ref name="PMID22705788" /> | ||
| - | קביעת מבנה גבישי של קטעי קרטין חשפה כי רוב הקשרים בין שני הסלילים שיוצרים את הדימר המלופף הם קשרים הידרופוביים | + | קביעת מבנה גבישי של קטעי 2B של קרטין חשפה כי רוב הקשרים בין שני הסלילים שיוצרים את הדימר המלופף הם קשרים הידרופוביים. |
| - | פילמנטים בינוניים נמצאים בתוך הציטופלסמה בסביבה עשירה ביונים | + | פילמנטים בינוניים נמצאים בתוך הציטופלסמה בסביבה עשירה ביונים - אם הקשרים בין הסיבים היו בעיקר קשרים אלקטרוסטטיים, אז היונים בסביבת החלבונים היו יכולים להשפיע על הקשר באזורים החשופים של חלבונים אלה ובכך לשנות את המבנה. דווקא נוכחותם של קשרים הידרופוביים מאפשרת לחלבונים אלה להיקשר זה לזה גם בסביבה עשירה ביונים. |
| - | קצוות אמינו וקרבוקסי של קרטין אלפא, עשירים בחומצות אמינו מסוג Cys. תפקידם של קצוות אלה בקשרים בתוך הסיבים אינו ידוע, אבל ייתכן כי Cys אלו משתתפים ביצירה של קשרי דיסולפיד בין חלבונים ובכך מחזק את מבנה הסיב. | + | קצוות אמינו וקרבוקסי של קרטין אלפא, עשירים בחומצות אמינו מסוג Cys. תפקידם של קצוות אלה בקשרים בתוך הסיבים אינו ידוע, אבל ייתכן כי Cys אלו משתתפים ביצירה של קשרי דיסולפיד בין חלבונים ובכך מחזק את מבנה הסיב. |
==מקורות== | ==מקורות== | ||
<div dir='ltr'> | <div dir='ltr'> | ||
| - | <references/> | + | <references /> |
Revision as of 09:44, 25 January 2013
|
חלבונים מסוג קרטין יוצרים מבנים סיביים בתוך תאי אפיתל. סיבים שנוצרים ע"י קרטינים נקראים פילמנטים בינוניים, באנגלית: intermediate filaments. מערכת זו הינה אחת משלוש מערכות של שלד תאי (ציטוסקלטון) שנמצאות ברוב התאים. שתי המערכות האחרות הן: מיקרופילמנטים המורכבים מחלבון אקטין ומיקרוטובולים המורכבים מחלבון מסוג טובולין.
בעוד שמיקרופילמנטים ומיקרוטובולים מורכבים מחלבונים כדוריים (globular), פילמנטים בינוניים מורכבים מחלבונים סיביים (fibrous) בעלי מבנה סיבי ארוך שאינם כדוריים.
בנוסף לתאי אפיתל, קרטינים הם מרכיבים מרכזיים בשערות ובצמר. בשערה, קרטינים יוצרים את הציר המרכזי לאורך השערה. מבנה סיבים אלה מחוזק על ידי חלבונים אחרים שנקראים בשם "חלבונים שקשורים לקרטין" - באנגלית: keratin associated proteins. חלבונים אלה נקשרים לקרטינים בקשרי דיסולפידי לחיזוק המבנה הסיבי.
Contents |
מבנה ראשוני של חלבונים מסוג קרטין
ביונקים ישנה משפחה גדולה של חלבונים מסוג קרטין שמתבטאים באופן ספציפי בתאים שונים. חלבונים אלה מראים שונות בגודלם ומשקלם המולקולרי נע בטווח בין 50 עד לכ-70 קילודלטון.
המבנה הראשוני של קרטין נקבע לראשונה ע"י חוקר ישראלי שעבד באוניברסיטת שיקגו. [1] [2] עבודות אלה חשפו כי ישנם שני סוגים של קרטינים שנקראו בשם קרטין מסוג I וקרטין מסוג II, באנגלית: Type I and Type II.
קביעת רצף הגנום האנושי חשפה כי בבן אדם ישנם 54 גנים שמקודדים לקרטינים. [3][4] גנים אלה ממוקמים באופן מרוכז בשני כרומוזומים. מיקום של גנים הומולוגיים בשכנות מעיד על כך שגנים אלה נוצרו כתוצאה של דופליקציה של גנים. כל הקרטינים הומולוגיים זה לזה ברצף השיירים שלהם. ניתן לסווג את הקרטינים לשתי קבוצות, סוג I ו-II בהתאם להגדרה המקורית של חנוקוגלו. לרוב, קרטינים מסוג I הם קטנים יותר וחומציים. לעומתם קרטינים מסוג II הם ארוכים יותר ובסיסיים.
אם קרטינים הם הומולוגיים ברצפם אז נשאלת השאלה, מה הם ההבדלים בין הקרטינים השונים?
קביעת רצפם של שני סוגי הקרטינים חשפה כי בחלבונים אלה הומולוגיה עיקרית נראית בחלק המרכזי של החלבונים שהוא באורך של כ-300 שיירים. לעומת חלק מרכזי זה, קצוות אמינו וקרבוקסי של הקרטינים מראים שונות גדולה. ההבדלים בגודלם של הקרטינים נובעים משונות באורכם של קצוות אמינו וקרבוקסי שנקראים בהתאמה הראש והזנב של מולקולת קרטין.
מבנה שניוני של קרטנים
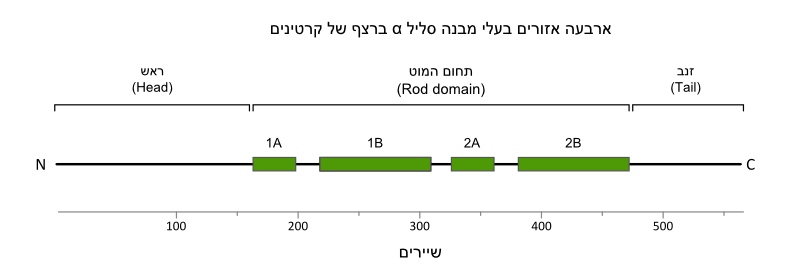
אנליזת הרצף של שני סוגי הקרטינים הביאה למסקנה כי בחלבונים אלה ישנם ארבעה קטעים מרכזיים בעלי מבנה שניוני סליל אלפא. [1] [2] כפי שנראה באיור להלן, ארבעה קטעים אלו נקראים: 1A 1B 2A 2B. קצוות אמינו וקרבוקסי של קרטינים הם שונים מאד הן באורך והן ברצף שלהם. והמבנה שלהם אינו ידוע.
קביעת מבנה שלישוני של חלבון דורשת יצירת גביש של חלבון שניתן לקבוע את מבנהו בשיטת קריסטלוגרפיית קרני X. בגלל הנטייה של קרטינים ליצור סיבים באופן ספונטני, לא ניתן ליצור גבישים של קרטינים שלמים. לכן עד כה לא נקבע מבנה שלישוני של אלפא קרטין שלם. אבל בעזרת שיטות הנדסה גנטית, חוקרים יצרו קטעי גנים שמקודדים לאזור 2B- הקטע באורך של כ-90 שיירים שנמצא בקונפורמציה של סליל אלפא בהתאם למודל לעיל. קביעת מבנה גבישי של קטע זה הוכיח שאכן קטע זה הוא במבנה סליל אלפא. [5]
מבנה שלישוני ורביעוני של קרטינים
ישנן מספר ראיות שסיבי אלפא קרטין מורכבים ממבנה בסיסי של דימר של קרטין מסוג I עם קרטין מסוג II. שני חלבונים אלה מלופפים ביחד בקטעים בעלי מבנה סליל אלפא ויוצרים מבנה שנקרא מבנה סלילי מלופף ( coiled coil). קביעת מבנה גבישי של קטע 2B של קרטין הוכיחה שאכן שני הקרטינים בקטעים אלה נמצאים במבנה מלופף. [5]
במבנה רביעוני של קרטינים, לכל מולקולת קרטין ישנם שני סוגי אינטראקציות: 1. דימר של קרטין נצמד לעוד דימר של קרטין ליצור טטרמר שמורכב מארבע מולקולות של קרטין. 2. כל מולקולת קרטין נקשר בקצהו לקרטין אחר ליצור שרשרת ארוכה של סיבי קרטין. [6]
הקשרים במבנה מלופף של סליל אלפאcoiled coil
|
שאלה מרכזית אחת לגבי מבנה רביעוני של אלפא קרטינים היא איזה סוג של קשר מחזיק את סלילי הקרטין ביחד במבנה מלופף. עוד לפני שפענוח מבנה גבישי של אלפא קרטינים, על בסיס מודלים של מבנה מלופף coiled coil , חוקרים נבאו כי במבנה מלופף סלילי אלפא נקשרים זו לזה בעזרת קשרים הידרופוביים בין שיירים אפולריים. במבנה של סליל אלפא ישנם 3.6 שיירים בכל סיבוב של סליל. בגלל מחזוריות זו, ישנו גם מחזוריות בנקודות מגע בין שני סלילים מלופפים. מחזוריות זו נראה במיקומם של שיירים אפולריים במקומות A ו-D במחזור שנקרא Heptad repeat של שבעה שיירים שמיוצגים באותיות ABCDEFG . [5]
קביעת מבנה גבישי של קטעי 2B של קרטין חשפה כי רוב הקשרים בין שני הסלילים שיוצרים את הדימר המלופף הם קשרים הידרופוביים.
פילמנטים בינוניים נמצאים בתוך הציטופלסמה בסביבה עשירה ביונים - אם הקשרים בין הסיבים היו בעיקר קשרים אלקטרוסטטיים, אז היונים בסביבת החלבונים היו יכולים להשפיע על הקשר באזורים החשופים של חלבונים אלה ובכך לשנות את המבנה. דווקא נוכחותם של קשרים הידרופוביים מאפשרת לחלבונים אלה להיקשר זה לזה גם בסביבה עשירה ביונים.
קצוות אמינו וקרבוקסי של קרטין אלפא, עשירים בחומצות אמינו מסוג Cys. תפקידם של קצוות אלה בקשרים בתוך הסיבים אינו ידוע, אבל ייתכן כי Cys אלו משתתפים ביצירה של קשרי דיסולפיד בין חלבונים ובכך מחזק את מבנה הסיב.
מקורות
- ↑ 1.0 1.1 Hanukoglu I, Fuchs E. The cDNA sequence of a human epidermal keratin: divergence of sequence but conservation of structure among intermediate filament proteins. Cell. 1982 Nov;31(1):243-52. PMID:6186381
- ↑ 2.0 2.1 Hanukoglu I, Fuchs E. The cDNA sequence of a Type II cytoskeletal keratin reveals constant and variable structural domains among keratins. Cell. 1983 Jul;33(3):915-24. PMID:6191871
- ↑ Schweizer J, Bowden PE, Coulombe PA, Langbein L, Lane EB, Magin TM, Maltais L, Omary MB, Parry DA, Rogers MA, Wright MW. New consensus nomenclature for mammalian keratins. J Cell Biol. 2006 Jul 17;174(2):169-74. Epub 2006 Jul 10. PMID:16831889 doi:10.1083/jcb.200603161
- ↑ Hesse M, Zimek A, Weber K, Magin TM. Comprehensive analysis of keratin gene clusters in humans and rodents. Eur J Cell Biol. 2004 Feb;83(1):19-26. PMID:15085952
- ↑ 5.0 5.1 5.2 Lee CH, Kim MS, Chung BM, Leahy DJ, Coulombe PA. Structural basis for heteromeric assembly and perinuclear organization of keratin filaments. Nat Struct Mol Biol. 2012 Jun 17;19(7):707-15. doi: 10.1038/nsmb.2330. PMID:22705788 doi:10.1038/nsmb.2330
- ↑ Popescu C, Hocker H. Chapter 4. Cytomechanics of hair basics of the mechanical stability. Int Rev Cell Mol Biol. 2009;277:137-56. doi: 10.1016/S1937-6448(09)77004-2. PMID:19766969 doi:10.1016/S1937-6448(09)77004-2