1. הקדמה:
הינו החלבון העיקרי המצוי בביצה (מהווה 60-65% מכלל חלבוני הביצה). חלבון זה שייך למשפחת הסרפינים, המונה מעל 1000 חלבונים, אך בניגוד ליתר חברי המשפחה חסר את תכונת העיכוב. בשל זמינותו בכמויות גדולות הוא שימושי מאוד בחקר חלבונים. מלבד זאת הוא משמש כסמן משקל-מולקולרי לכיול הפרדת חלבונים בג'לים אלקטרופורזה. אובלבומין הינו כלאטור של מתכות כבדות, ולכן משמש בטיפול במיקרים החשודים כהרעלת מתכות. תיפקודו של האובלבומין אינו ידוע, אך סוברים שהוא חלבון שימור (Storage protein) עקב כמויותיו הגדולות כחלבון עוברי.
2. למרות מחקר נרחב על החלבון, תפקודו נשאר בלתי פתור. כיצד אנו יכולים ללמוד על תפקוד החלבון ממבנהו?
אובלבומין הינו חלבון ממשפחת הסרפינים, אשר חולקים מבנה שלישוני דומה (30% הומולוגיה). חברי משפחה זו הינם חלבונים מסוג מעכבי פרוטאזות הנקשרים לחלבונים אחרים ומעכבים את פעילותם, כגון מעכבי סרין או ציסטאין פרוטאזות, מעכבי שפרונים, או מעכבי טרנספורטים של הורמונים. חלק מחלבוני המשפחה מתפקדים כחלבוני שימור (storage). עד היום, תפקיד האובלבומין אינו ידוע ורווחת הדעה שהוא משמש כחלבון שימור. רב חברי משפחת הסרפינים מורכבים ממבני אלפא-הליקס ומשטחי-בטא ומלופ-מרכזי (RCL: reactive center loop), החיוני לתפקודו של החלבון.
3. מבנה החלבון:
אובלבומין הוא חלבון המורכב מ - 385 ומסה של 45 קילו דלתון. לחלבון ארבעה דומיינים
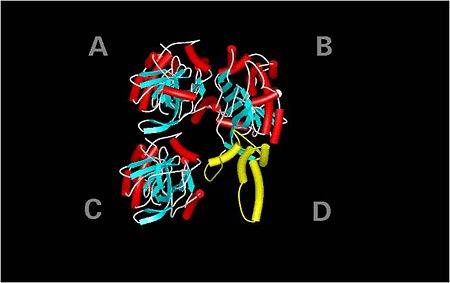
ארבעת הדומיינים של האובלבומין. דומיין D קצר יותר ומורכב מעיקר ממבני אלפא הליקס
כאשר דומיינים A, B ו – C מכילים גם מיבני אלפא-הליקס וגם משטחי בטא. דומיין D הוא קטן יותר ומכיל בעיקר אלפא-הליקס, ונקרא הלופ החשוף של אובלבומין.
לאחר שלב התרגום אובלבומין עובר שינויים ברצף שלו וכן נוספות לו תוספות כימיות המכונות באופן כללי מודיפיקציות פוסט-תירגומיות: 1) לאחר הסרת המתיונין הראשוני מתווספת קבוצת אצטיל (CH4) לקצה ה-N טרמינלי החדש. 2) פוספורילציה של שני שיירי סרין (69 ו-345). 3) אתר גליקוזילציה על חומצה אספרטית 293 שמקבל את השייר הסוכרי N-acetyl-D-glucosamine.
האובלבומין מכיל שישה ציסטאינים, ששנים מהם (74 ו-121) יוצרים גשר די-סולפידי.
כמו כן, החלבון קושר יון סידן ע"י שני השיירים סרין 345 וחומצה גלוטאמית 192.
אובלבומין מיוחד בזה שהוא מכיל את כל חומצות האמינו הקיימות, ולכן יכול לשמש כחלבון שימור, שפירוקו מספק את כלל חומצות האמינו הדרושות להתפתחות עוברית.
4. שימוש בגרף רמצ'נדראן כתמונה או כלינק ירוק והתייחסות למבנים השניוניים שניתן לזהות בו והקשר שלהם למבנה החלבון.
5. תיאור הפעילות של החלבון :
הומולוגיית מבנה עם חלבונים אחרים יכולה לרמז על תיפקוד אפשרי לאובלבומין. לאובלבומין הומולוגיית מבנה של 30% לסרפינים.

דמיון מבני מהותי בין אובלבומין לאנטיטריפסין
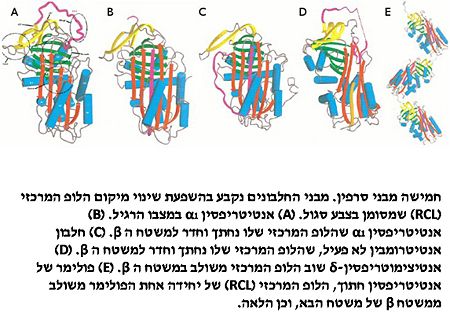
לרוב חברי הסרפינים קיים לופ מרכזי (RCL) האחראי ליצירת שינויים מבניים גדולים במבנה החלבון, ולכן חיוני לתפקודו. באובלבומין הלופ המרכזי בנוי משיירים 350-360, היוצרים מבנה של הליקס, בעוד אצל שאר חברי הסרפינים מרכז זה הינו לופ ויתכן שאף הליקס.
בעוד שבסרפינים אחרים הלופ המרכזי יכול להכנס בין גדילי הבטא של דומיין A באותו חלבון או בחלבונים אחרים (לדוגמא החלבון אנטי-טריפסין ממשפחת הסרפינים, שמאמץ מספר מצבים בהתאם למיקום הלופ המרכזי), הלופ המרכזי באובלבומין אינו עובר את השינוי המבני הזה.
מתוך ידיעת מיבני הסרפינים היכולים להחדיר את הלופ המרכזי בין גדילי הבטא, נמצא כי לחומצה אמינית הראשונה שחודרת תפקיד מכריע בייצוב במבנה החדש. באובלבומין חומצה אמינית זו היא ארגינין. קיימת הסברה כי בשל היותה חומצה אמינית טעונה, היא הופכת את הלופ לפחות יציב מבחינה תרמו דינמית, ולכן אינו יכול להיות מוחדר בין גדילי הבטא.
סיכום :
הימצאותו בטבע בכמויות גדולות מחד, וחוסר הידע לגבי פעילותו מאידך מציבים את האובלבומין כחלבון מאתגר מבחינה מחקרית. העובדה שיש לו הומולוגיה משמעותית למשפחת הסרפינים, ובכל זאת אינו נושא את תכונת עיכוב פרוטאזות של בני המשפחה וכן היכולת שלו לשאת מולקולות סוכר ומים הובילה את החוקרים להנחה כי החלבון מספק נוטריינטים ואנרגיה לעובר הגדל.
6. רפרנס:
1. http://users.aber.ac.uk/bcc9/downloads/Ovalbumin.pdf
2. http://www.nostatic.com/proteins/ovalbumin/OvalStrucFunc.htm
3. http://en.wikipedia.org/wiki/Ovalbumin
4. http://www.neovatech.com/ovo_oval1.php
5. http://www.sciencedirect.com/science/article/pii/S0378434701001086