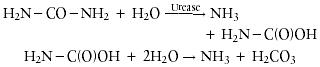מבוא
האנזים אוראז הוא חלבון מקבוצת המטאלופרוטאינים הקשור ליוני המתכת ניקל הדרושים לפעילותו. הוא מיוצר על ידי צמחים, פטריות, ומספר חיידקים.
אוראז שהופק משעועית זכה להיות האנזים הראשון שגובש והוגדר כחלבון[1] (1926).
אוראז מזרז הידרוליזה של אוריאה כדי ליצור אמוניה וחומצה פחמתית.
אוראז הוא אחד האנזימים הבודדים הדורשים ניקל כדי לפעול . הניקל קשור לאוראז בקשר בעל אפיניות גבוהה מאד ורק דנטורציה או שימוש בחומצה חזקה יכולים לפרק את הקשר.
אנזים האוראז מווסת ע"י חלבונים נוספים.
אחד החיידקים הידועים כבעלי אוראז הוא הליקובקטר פילורי, חיידק זה ידוע כמעורב ביצירת כיביים ובסרטן הקיבה.
האוראז נמצא בזרעי קטניות וכנראה בעל תפקיד בנביטה.
תגובה אנזימתית
האוראז מזרז הידרוליזה של אוריאה לקבלת התוצר אמוניה וקרבמאט (תוצר ביניים). קרבמאט מתפרקת באופן ספונטני למולקולה נוספת של אמוניה וחומצה פחמתית:
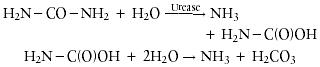
בתמיסות מימיות, החומצה הפחמתית המשוחררת ושתי המולקולות של אמוניה נמצאות בשיווי משקל בין שתי צורותיהן (המיוננת והלא מיוננת), מה שמעלה את ה- pH לבסיסי יותר.
מבנה המולקולה
בצמחים אוריאז מורכב מפפטיד בעל יחידה אחת וזאת בניגוד לחיידקים בהם אוראז מורכב משתי תת יחידות
α ו β ולעיתים גם γ,
כל תת יחידה בנויה של סלילי α ומשטחי β.
מבנה האוריאז בהליקובקטר פילורי גדול מאד גם יחסית לחיידקים אחרים הוא מורכב מ-807 ומסתו המולקולרית היא כ-550kDa.
האתר הפעיל של האנזים נמצא בתת היחידה β האתר הפעיל בנוי מחומצות האמינו היסטידין 136, היסטידין 138, ליזין 219, היסטידין 248, היסטידין 274, ואספרטאט 362 המתקרבות במבנה השלישוני בעקבות יצירת קשרים בין מולקולריים ובאות במגע במגע ישיר עם 2 , היסטידין 221 והיסטידין 322 הסמוכים לאתר הפעיל יוצרים קשר עם האוריאה והמים לזרוז תהליך הפיכת האוריאה לאמוניה.
להליקובקטר שישה עותקים לכל אחת משתי תת היחידות, α ו β, ולכן שישה אתרים פעילים למולקולת האנזים הטעונה במלואה.
למרות ההבדל בין מבנה האוראז בחיידק ובצמח האתר הפעיל דומה בשניהם.
במיקרוסקופ אלקטרונים אוראז נראה במבנהכדורי חלול במרכז, האנזים בעל קוטר של 13 ננומטר ובעל סימטריה סיבובית.
גנטיקה
צבר של שבעה גנים הנמצאים ברצף כעותק יחיד על הכרומוזום מקודדים ליצור האנזים אוראז ולוויסות פעולתו. הגנים UreA ו-UreB מקודדים את היחידות בעלות המסה המולקולרית של כ- 26.5kDa ו-60.3kDa בהתאמה. שישה עותקים של כל תת יחידה מתחברים עצמאית באופן ספונטני ליצירת האנזים הפעיל.
הגנים ureE, ureF, ureG, and ureH מקודדים לחלבונים UreE, UreF, UreG, and UreH, שמסייעים בהכנסתו של יון הניקל לאנזים, הימצאותם של יוני הניקל הכרחיים לפעילותו.
הגן ureI הוא גן מווסת המיועד לקידוד תעלות אוריאה ספציפיות בממברנה שנפתחות כאשר הpH נמוך על מנת לאפשר מעבר של אוריאה, ונסגרות כאשר הpH גבוה בכדי למנוע גישה של הסובסטרט לאוראז הציטופלסמתי.
יחידת המשנה של UreA של הליקובקטר היא יוצאת דופן במקצת בגלל רצף חומצות האמינו שלה המקודדות על ידי גן יחיד ureA, ואילו בכל מיני חיידקים אחרים הן תמיד מקודדות על ידי שני גנים נפרדים. ההשערה העולה היא ששני גנים קטנים יותר של מינים שונים התמזגו כדי ליצור את האוראז בהליקובקטר פילורי.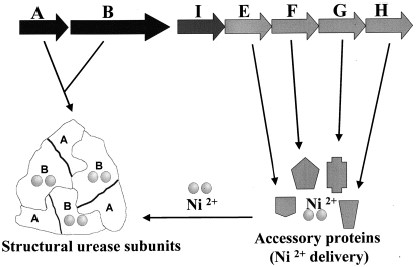
Function
Disease
Relevance
Structural highlights
This is a sample scene created with SAT to by Group, and another to make of the protein. You can make your own scenes on SAT starting from scratch or loading and editing one of these sample scenes.
</StructureSection>
References
http://pubs.acs.org/doi/abs/10.1021/ar960022j
Devesa SS, Blot WJ, Fraumeni JF. Changing patterns in the incidence of esophageal and gastric carcinoma in the United State. J. Cancer . 1998;83:2049–2053. [PubMed]