Human Insulin Degrading Enzyme (Hebrew)
From Proteopedia
| Line 27: | Line 27: | ||
==<center>'''פונקציות'''</center>== | ==<center>'''פונקציות'''</center>== | ||
<p dir='rtl'> | <p dir='rtl'> | ||
| - | האנזים מפרק האינסולין אובחן לראשונה בשנת 1949 כבעל היכולת לפרק את ההורמון אינסולין (ומכאן אפוא נגזר שמו). בשנת 1988 התגלה כי אנזים זה חותך באופן ספציפי את שרשרת B של ההורמון אינסולין. לאחר מכן, בהשוואה שעשו עם פרוטאזות שונות התגלה שאנזים זה מסוגל לבצע פעילות קטאליטית על סובסטרטים שונים, ביניהם ההורמונים גלוקגון (אנטגוניסט לאינסולין), TFG-alpha וביטא אנדרופין. בנוסף לרגולציה על הורמונים אלו, בשנת 1994 הראו כי לאנזים IDE יש תפקיד גם בפירוק של החלבון [https://he.wikipedia.org/wiki/%D7%97%D7%9C%D7%91%D7%95%D7%9F_%D7%A2%D7%9E%D7%99%D7%9C%D7%95%D7%90%D7%99%D7%93_%D7%91%D7%98%D7%90 עמילואיד-ביטא], [https://he.wikipedia.org/wiki/%D7%9E%D7%97%D7%9C%D7%AA_%D7%90%D7%9C%D7%A6%D7%94%D7%99%D7%99%D7%9E%D7%A8 | + | האנזים מפרק האינסולין אובחן לראשונה בשנת 1949 כבעל היכולת לפרק את ההורמון אינסולין (ומכאן אפוא נגזר שמו). בשנת 1988 התגלה כי אנזים זה חותך באופן ספציפי את שרשרת B של ההורמון אינסולין. לאחר מכן, בהשוואה שעשו עם פרוטאזות שונות התגלה שאנזים זה מסוגל לבצע פעילות קטאליטית על סובסטרטים שונים, ביניהם ההורמונים גלוקגון (אנטגוניסט לאינסולין), TFG-alpha וביטא אנדרופין. בנוסף לרגולציה על הורמונים אלו, בשנת 1994 הראו כי לאנזים IDE יש תפקיד גם בפירוק של החלבון [https://he.wikipedia.org/wiki/%D7%97%D7%9C%D7%91%D7%95%D7%9F_%D7%A2%D7%9E%D7%99%D7%9C%D7%95%D7%90%D7%99%D7%93_%D7%91%D7%98%D7%90 עמילואיד-ביטא], חלבון שהצטברותו (אגרגציה) בתא נמצאת בקורלציה עם [מחלת האלצהיימר https://he.wikipedia.org/wiki/%D7%9E%D7%97%D7%9C%D7%AA_%D7%90%D7%9C%D7%A6%D7%94%D7%99%D7%99%D7%9E%D7%A8],[סכרת סוג 2 https://he.wikipedia.org/wiki/%D7%A1%D7%95%D7%9B%D7%A8%D7%AA_%D7%9E%D7%A1%D7%95%D7%92_2] ועוד. |
נמצא כי מוטציות באזורים ספציפים בחלבון יכולים להוביל לתעדוף של הקונפורמציה הפתוחה, מה שהוביל לקינטיקה גבוה יותר פי 40. | נמצא כי מוטציות באזורים ספציפים בחלבון יכולים להוביל לתעדוף של הקונפורמציה הפתוחה, מה שהוביל לקינטיקה גבוה יותר פי 40. | ||
Revision as of 09:29, 6 July 2020
אנזים מפרק אינסולין (Insulin-degrading enzyme, IDE), הוא פרוטאז. ששמו נגזר מתפקודו העיקרי בתא - לפרק את ההורמון הפפטידי אינסולין, הורמון האינסולין מופרש מבלוטת הלבלב כאשר הפונקציה המרכזית שלו היא לווסת את רמת הסוכר בדם על ידי הגדלת מספר התעלות לסוכר בתאי המטרה ובכך להגביר את ספיגת הגלוקוז על-ידם, כמו גם לעודד יצירת חומרי תשמורת (גליקוגן ושומן). להורמון אינסולין חשיבות מכרעת בתפקודו התקין של הגוף והיא מודגמת היטב במחלת סוכרת בה ישנה פגיעה בתפקוד או בהפרשת האינסולין לזרם הדם, מה שעלול להוביל למחלות מטאבוליות ולתופעות בריאותיות חמורות. הרגולציה על אינסולין בתיווכו של האנזים מפרק האינסולין יכולה אם כן לתרום להבנת המנגנון המבקר על תפקודו התקין של האינסולין וייתכן גם על דרכים תֵּרָפּוֹיְטִיּוֹת חדשות לטיפול במחלת הסכרת על כל סוגיה.
Contents |
מבנה
|
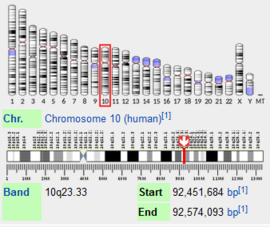
בבני אדם, הגן לאנזים זה נמצא בכרומוזום מס' 10, והוא מכיל 28 אקסונים. בעקבות שחבור חלופי, נוצרים לחלבון זה שני איזופורמים, האחד מכיל 1019 חומצות אמינו והנפוץ יותר, והשני קצר יותר ומכיל 464 חומצות אמינו. בערך זה נדבר על האיזופורם הגדול יותר, אשר משקלו המולקולרי עומד על כ-118kDa.
מבוסס על מבנים סלילניים המכונים helix - α (המופיעים בורוד), ומשטחי β הנקראים sheet – β (המופיעים בצהוב) וחיבורים מסתלסלים coiled coil (המופיעים בשחור). לפי מה שיודע ביוניפרוט, בעקבות שחבור חלופי, נוצרים שני איזופורמים שונים. החלבון הנוכחי הינו הארוך יותר, והוא מורכב מ1019 (כל הצבעים מייצגים חומצות אמינו שונות). לאנזים יש שלוש המסומנות בבורדו (108 ,112 ,189) ליוני המתכת אבץ Zn+2, .המהווים חלק מהאתר הפעיל הפרוטאוליטי של האנזים
לחלבון יש שני קונפורמציות מרחביות; האחת פתוחה, בה האתר הפעיל חשוף יותר להיקשרות סוּבְּסְטְרָט, ובה האתר הפעיל קושר האבץ חסום עי ידי שיירים של החלבון.
פונקציות
האנזים מפרק האינסולין אובחן לראשונה בשנת 1949 כבעל היכולת לפרק את ההורמון אינסולין (ומכאן אפוא נגזר שמו). בשנת 1988 התגלה כי אנזים זה חותך באופן ספציפי את שרשרת B של ההורמון אינסולין. לאחר מכן, בהשוואה שעשו עם פרוטאזות שונות התגלה שאנזים זה מסוגל לבצע פעילות קטאליטית על סובסטרטים שונים, ביניהם ההורמונים גלוקגון (אנטגוניסט לאינסולין), TFG-alpha וביטא אנדרופין. בנוסף לרגולציה על הורמונים אלו, בשנת 1994 הראו כי לאנזים IDE יש תפקיד גם בפירוק של החלבון עמילואיד-ביטא, חלבון שהצטברותו (אגרגציה) בתא נמצאת בקורלציה עם [מחלת האלצהיימר https://he.wikipedia.org/wiki/%D7%9E%D7%97%D7%9C%D7%AA_%D7%90%D7%9C%D7%A6%D7%94%D7%99%D7%99%D7%9E%D7%A8],[סכרת סוג 2 https://he.wikipedia.org/wiki/%D7%A1%D7%95%D7%9B%D7%A8%D7%AA_%D7%9E%D7%A1%D7%95%D7%92_2] ועוד. נמצא כי מוטציות באזורים ספציפים בחלבון יכולים להוביל לתעדוף של הקונפורמציה הפתוחה, מה שהוביל לקינטיקה גבוה יותר פי 40.
חשיבות קלינית
Structural highlights
</StructureSection>