שלד התא
שלד התא הוא רשת סבוכה של סיבים דקים המהווים את התשתית עליה בנוי התא. שלד זה שומר את האברונים במקומם ומונע מהם לצוף בנוזל התוך-תאי (ציטופלזמה) ולנדוד ממקום למקום. בנוסף הוא משמש גם כמעין רשת של פסי רכבת שחומרים ואברונים נעים עליהם באופן מסודר ברחבי התא החי. מבנה השלד התוך תאי מקנה לתאים את צורתם ומאפשר תנועה עצמאית של התאים ושותף בתהליכי חלוקת התא.
השלד מורכב מסוגי סיבים חלבוניים שונים, ביניהם אקטין ומיוזין.
חלבון המיוזין
מיוזין הינו חלבון המהווה מרכיב מרכזי במערכת סיבי שלד התא, בערך זה נתמקד במבנהו ותפקודו בתאי שריר. השרירים בגופנו אחראים על כל הפעולות שדורשות תנועה כלשהי, החל בתנועות רצוניות כמו הליכה, אחיזה או הנעה של האיברים וכלה בתנועות לא רצוניות כמו נשימה, פעימות לב, הנעת מערכת העיכול, הפרשות ועוד. לכל השרירים בגוף יש מנגנון פעולה דומה, שכולל פעילות תלוית סידן ו-ATP של מנוע מולקולרי בשם מיוזין, שמחליק על גבי סיבי אקטין.
מבנה המיוזין
המיוזין הינו חלבון המצוי בציטפלזמה של תאי שריר.
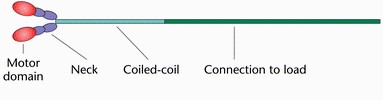
כל מולקולת חלבון מיוזין בנויה משני "ראשים" ו"זנב" אחד ארוך במבנה צר.המיוזין מסודר בצורה של סיב, כאשר מספר מולקולות מלופפות באזור זנבותיהן והראשים פונים לכיוונים מנוגדים.
ה"זנב" מורכב משני שרשראות של חומצות אמיניות המאורגנות כל אחת במבנה של אלפא הליקס. השרשראות מלופפות זו על זו במבנה סליל כפול (בדומה למבנה הדנ"א).
ה"ראשים" נמצאים בקצה המולקולה ובהם מתקיימות שני פעולות המשמשות כמעין מנוע מולקולרי הממיר אנרגיה כימית לארגיה מכנית:
א. פעילות ATPase : פירוק מולקולת ATP ל ADP+Pi.
ב. פעילות מוטורית: מאפשרת את התנועה של סיבי השריר.
בעמוד זה נתמקד במבנה
פעילות אקטין-מיוזין
על מנת שחלבון המיוזין יבצע את פעילותו המוטורית עליו להיקשר לסיב האקטין.
הקשר בין מולקולות האקטין למיוזין מתבצע באזור ה"ראשים" של מולקולות המיוזין, בשתי אתרי קישור: האתר הראשון מורכב מ - 13 חומצות אמינו (667-689), רובן פולריות, היוצרות קשרי מימן. האתר השני מורכב מ - 15 חומצות אמינו (768-782), רובן פולריות וטעונות חיובית, היוצרות קשרי מימן וקשרים יוניים.
בהדמיה ניתן לראות את
בשריר המשורטט (שרירי השלד), מולקולות המיוזין יוצרות מבנה של סיב עבה המכיל 300-400 מולקולות (המקנה לאזור צבע כהה), ולצידו אזור של מולקולות אקטין היוצרות מבנה של סיב דק (מקנה לאזור צבע בהיר). האזור הבהיר מכונה "Z-disc".
בקצוות המבנה הקוטבי בולטים "ראשים" של המיוזין הפונים לכיוונים מנוגדים, והאזור המרכזי של המבנה אינו מכיל "ראשים".
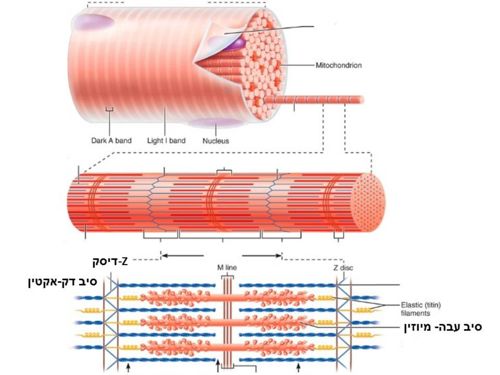
מבנה תא השריר וסידור סיבי האקטין והמיוזין
מנגנון התכווצות השריר מבוסס על אינטראקציה בין כמה גורמים:
● סיבים דקים – מולקולות האקטין
● סיבים עבים – מולקולות המיוזין
● מולקולות חלבון שונות – טרופומיוזין (Tropomyosin) וטרופונין
● יוני סידן
● ATP
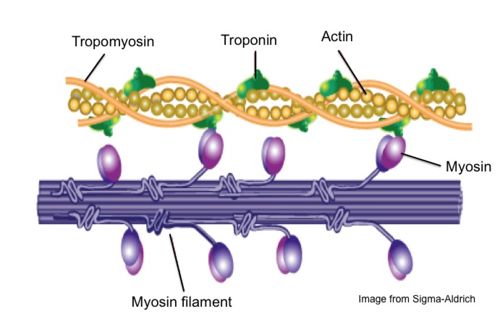
סיבי האקטין והמיוזין, ניתן לראות את הראש המוטורי בשלבי החיבור השונים לסיב האקטין
הקשר בין כל גורמים אלה הוא בעובדה שהמולקולות בעלות הסיבים הדקים (אקטין, טרופומיוזין וטרופונין) מצויות במבנה מלופף סביב הסיבים העבים לאורך השריר (מיוזין). המבנה המרחבי של הקומפלקס אקטין-טרופומיוזין-טרופונין, אשר במצב קשור חוסם את אתרי הקשירה לאקטין, מונע את התקשרות האקטין למיוזין וכך גם אינו מאפשר את התכווצות השריר. מנגנון התכווצות השרירים מבוסס על כושר התנועה של "ראשי" מולקולות המיוזין.
הסרטון הבא ממחיש את מבנה סיבי החלבון בשריר.
קיימים ארבעה שלבים הגורמים לתנועתם:
1 השלב הראשון נקרא "מחובר" (attached) . בשלב זה, יש צורך לגרום לתנועה של מולקולות הטרופונין והטרופומיוזין, כיוון שהן חוסמות את אתרי הקישור. תהליך זה מתבצע על ידי קשירת יוני סידן לטרופומיוזין. קשירה זו גורמת לטרופומיוזין לנוע מאתר הקישור וכך מתאםשרת אינטראקציה מרחבית בין האקטין למיוזין.
2 "משוחרר" (release) - הקשר בין המיוזין לאקטין משתחרר בעקבות קשירת ATP למולקולת המיוזין. השרירים מצויים בשלב זה במצב נוקשה.
3"דרוך" (cocked) – הידרוליזה של ATP המחוברת ל"ראש" המיוזין גורמת למעין פעולת דריכה (בדומה לדריכה בכלי ירייה), כאשר תוצרי ההידרוליזה (ADP+Pi) נשארים קשורים ל"ראש" המולקולה.
4 "הפעלת כוח" (force generating) - המגע המינימלי בין "ראשי" המיוזין עם סיבי האקטין גורם לשחרור ה-Pi, תוצר הידרוליזת ה-ATP, שגורם לחיזוק ההתקשרות בין המיוזין לאקטין ולמעין התגבשות של המבנה כולו בכוחות דחיפה ודחיסה.
הסרטון הבא ממחיש את שלבי פעילות מנגנון הכיווץ - אקטין-מיוזין.
אנימציה קצרה ומקסימה של תנועת הראש המוטורי.
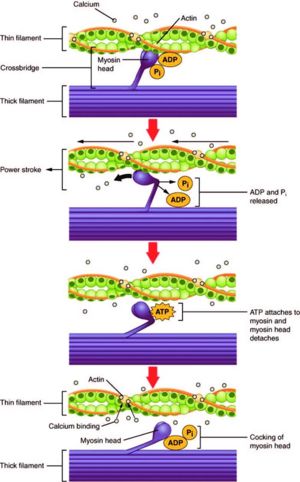
ATPשלבי קישור האקטין והמיוזין והידרוליזת מולקולת ה
motor domain מוטציות ב
מוטציות רבות בגנים המקודדים ל motor domain עלולות לגרום לקשיים בתפקוד תקין של פולת השרירים. למשל, מוטציות באזור הקשירה לאקטין ובאזור הקישור לATP בשריר הלב עלולות לגרום לFamilial hypertrophic cardiomyopathy, מחלה תורשתית בה נגרמת התעבות של שריר זה. ההתעבות גורמת לשאיבת הדם להתרחש בצורה לא יעילה ואף להוביל להתקף לב.
נמצא כי המוטציות כוללות שינוי בחומצות אמינו יחידות הסמוכות לאתרי הקישור לאקטין ולATP
(Val 606,Arg 403, Arg 249) גורמות לשיבוש במבנה המרחבי של המיוזין אשר גורם לפעילות לא תקינה של השריר.
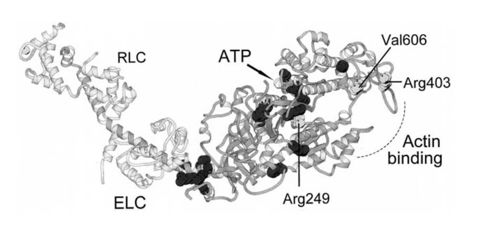
מוטציות נקודתיות באזור הראש המוטורי של המיוזין
You may include any references to papers as in: the use of JSmol in Proteopedia [1] or to the article describing Jmol [2] to the rescue.