Human Insulin Degrading Enzyme (Hebrew)
From Proteopedia
| Line 6: | Line 6: | ||
==<center>'''מבנה'''</center>== | ==<center>'''מבנה'''</center>== | ||
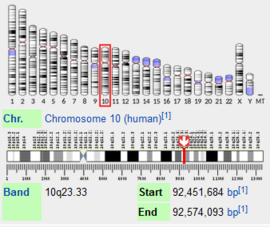
| - | + | [[Image:chromosome.PNG|thumb|270px|right|איור 1 - מיקום הגן של האנזים מפרק האינסולין באדם. כפי שניתן לראות, מיקומו של הגן נמצאה בזרועה הארוכה של הכרומוזום, מתחת לצנטרומר. אורך הגן הוא 122,409 זוגות בסיסים בדנ''א.]] | |
<p dir='rtl'> | <p dir='rtl'> | ||
חלבון זה הוא למעשה דימר, המורכב משני מונומרים (מוצגות בתכלת ובורוד). | חלבון זה הוא למעשה דימר, המורכב משני מונומרים (מוצגות בתכלת ובורוד). | ||
בבני אדם, הגן לאנזים זה נמצא בכרומוזום מס' 10, אורכו אורך הגן 122,409 זוגות בסיסים, כאשר רצף זה מכיל 28 [https://he.wikipedia.org/wiki/%D7%90%D7%A7%D7%A1%D7%95%D7%9F_(%D7%92%D7%A0%D7%98%D7%99%D7%A7%D7%94) אקסונים]. בעקבות [https://he.wikipedia.org/wiki/%D7%A9%D7%97%D7%91%D7%95%D7%A8_%D7%97%D7%9C%D7%99%D7%A4%D7%99 שחבור חלופי], נוצרים לחלבון זה שני [https://en.wikipedia.org/wiki/Protein_isoform איזופורמים], האחד מכיל 1019 חומצות אמינו והנפוץ יותר, והשני קצר יותר ומכיל 464 חומצות אמינו. בערך זה נדבר על האיזופורם הגדול יותר, אשר משקלו המולקולרי עומד על כ-118kDa. | בבני אדם, הגן לאנזים זה נמצא בכרומוזום מס' 10, אורכו אורך הגן 122,409 זוגות בסיסים, כאשר רצף זה מכיל 28 [https://he.wikipedia.org/wiki/%D7%90%D7%A7%D7%A1%D7%95%D7%9F_(%D7%92%D7%A0%D7%98%D7%99%D7%A7%D7%94) אקסונים]. בעקבות [https://he.wikipedia.org/wiki/%D7%A9%D7%97%D7%91%D7%95%D7%A8_%D7%97%D7%9C%D7%99%D7%A4%D7%99 שחבור חלופי], נוצרים לחלבון זה שני [https://en.wikipedia.org/wiki/Protein_isoform איזופורמים], האחד מכיל 1019 חומצות אמינו והנפוץ יותר, והשני קצר יותר ומכיל 464 חומצות אמינו. בערך זה נדבר על האיזופורם הגדול יותר, אשר משקלו המולקולרי עומד על כ-118kDa. | ||
<br> | <br> | ||
| - | + | ||
<br> | <br> | ||
</p> | </p> | ||
Revision as of 09:52, 13 July 2020
אנזים מפרק אינסולין (Insulin-degrading enzyme, IDE) הוא פרוטאז, ששמו נגזר מתפקודו העיקרי בתא - לפרק את ההורמון הפפטידי אינסולין. הורמון האינסולין מופרש מבלוטת הלבלב כאשר הפונקציה המרכזית שלו היא לווסת את רמת הסוכר בדם על ידי הגדלת מספר התעלות לסוכר בתאי המטרה ובכך להגביר את ספיגת הגלוקוז על-ידם, כמו גם לעודד יצירת חומרי תשמורת (גליקוגן ושומן). להורמון אינסולין חשיבות מכרעת בתפקודו התקין של הגוף והיא מודגמת היטב במחלת סוכרת בה ישנה פגיעה בתפקוד או בהפרשת האינסולין לזרם הדם, מה שעלול להוביל למחלות מטאבוליות ולתופעות בריאותיות חמורות. הרגולציה על אינסולין בתיווכו של האנזים מפרק האינסולין יכולה אם כן לתרום להבנת המנגנון המבקר על תפקודו התקין של האינסולין וייתכן גם על דרכים תֵּרָפּוֹיְטִיּוֹת חדשות לטיפול במחלת הסכרת על כל סוגיה.
|
Contents |
מבנה
חלבון זה הוא למעשה דימר, המורכב משני מונומרים (מוצגות בתכלת ובורוד).
בבני אדם, הגן לאנזים זה נמצא בכרומוזום מס' 10, אורכו אורך הגן 122,409 זוגות בסיסים, כאשר רצף זה מכיל 28 אקסונים. בעקבות שחבור חלופי, נוצרים לחלבון זה שני איזופורמים, האחד מכיל 1019 חומצות אמינו והנפוץ יותר, והשני קצר יותר ומכיל 464 חומצות אמינו. בערך זה נדבר על האיזופורם הגדול יותר, אשר משקלו המולקולרי עומד על כ-118kDa.
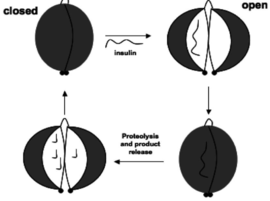
מבוסס על מבנים סלילניים המכונים helix - α (המופיעים בורוד), ומשטחי β הנקראים sheet – β (המופיעים בצהוב) וחיבורים מסתלסלים coiled coil (המופיעים בשחור). כאמור, בעקבות שחבור חלופי נוצרים שני איזופורמים שונים. החלבון הנוכחי הינו הארוך יותר, והוא מורכב מ1019 (כל הצבעים מייצגים חומצות אמינו שונות). לאנזים יש שלוש המסומנות בבורדו (108 ,112 ,189) ליוני המתכת אבץ Zn+2, כלומר, שלושה אתרי קישור שונים, המהווים חלק מהאתר הפעיל הפרוטאוליטי בכל מונומר המרכיב את האנזים. בכל העמדות הללו מופיעה החומצה האמינית היסטידין (H)המכילה בשייר שלה קבוצה המכונה אימידזול אשרה יכולה לקשור יוני מתכת (כדוגמת אבץ וניקל) בקשרים לא קוולנטים. עמדות אלו שמורות מבחינה אבולוציונית, כלומר גם ביצורים אחרים אשר מייצרים את האנזים מפרק האינסולין, עמדות הקישור למתכות זהות. כחלק מהרגולציה על פעילות החלבון, נקשרת מולקולת ATP המופיעה בכתום. בעמדה זו מופיעה החומצה האמינית ארגינין והיא שמורה אבולוציונית. הקישור של הATP לחלבון מוביל לשינוי בקונפורמציה המרחבית של החלבון החיונית לפעילות הקטאליטית שלו בפירוק הסובסטרט. (מוצגת במג'נטה) נמצאת בין שני קיפולי כל אחת מן השרשראות של החלבון. הרצף של עמדה זו (HLIGHEG) שמור אבולוציונית. התצמיד אנזים-סובסטרט משנה את הקונפורמציה המרחבית של הקומלקס, דבר שמאפשר את הפעילות הקטאליטית שמבצע האנזים (IDE) על הסובסטרט (אינסולין). אם כן, לחלבון יש שתי קונפורמציות מרחביות; האחת סגורה, בה האתר הקושר סובסטרט סגור במין כיס הידרופובי ואינו מאפשר לתצמיד אנזים-סובסטרט להיווצר, והשניה פתוחה, בה האתר הפעיל חשוף יותר להיקשרות הסובסטרט, ומתאפשרת היקשרות של הסובסטרט לעמדות קושרות אבץ שנמצאות באתר הפעיל (ראו איור 2)
פונקציות וחשיבות קלינית
האנזים מפרק האינסולין אובחן לראשונה בשנת 1949 כבעל היכולת לפרק את ההורמון אינסולין (ומכאן אפוא נגזר שמו). הסובסטרט אינסולין מורכב משתי שרשרות פוליפפטידיות; שרשרת ה-A הבנויה מ-21 חומצות אמינו ושרשרת ה-B הבנויה מ-30 חומצות אמינו. שתי השרשרות מחוברות באמצעות קשרים די-סולפידיים ומקופלות יחד. בשנת 1988 התגלה כי אנזים זה חותך באופן ספציפי את שרשרת B של ההורמון אינסולין. לאחר מכן, בהשוואה שעשו עם פרוטאזות שונות התגלה שאנזים זה מסוגל לבצע פעילות קטאליטית על סובסטרטים שונים, ביניהם ההורמונים גלוקגון (אנטגוניסט לאינסולין), TFG-alpha וביטא אנדרופין. בנוסף לרגולציה על הורמונים אלו, בשנת 1994 הראו כי לאנזים IDE יש תפקיד גם בפירוק של החלבון עמילואיד-ביטא, חלבון שהצטברותו (אגרגציה) בתא נמצאת בקורלציה עם מחלת האלצהיימר, סכרתת סוג 2 ועוד.
מוטציות חסר של הגן גורמת לאי סבילות לגלוקוז ואגרגציה של החלבון עמילואיד-ביטא.
למרות שרב הנסתר על הגלוי באשר למכניזם שמסביר את הקטליזה אותה מבצע האנזים, נמצא כי שלב קובע מהירות מותנה התקפה נוקלאופילית שמתרחשת כאשר יוני האבץ עוברים לסובסטרט. כפי שהוזכר, לחלבון זה שתי קונפורמציות מרחביות, כאשר הפתוחה מאפשרת קישור של הסובסטרט לעמדות קושרות אבץ שנמצאות באתר הפעיל.
נמצא כי מוטציות באזורים ספציפים בחלבון יכולים להוביל לתעדוף של הקונפורמציה הפתוחה, מה שהוביל לקינטיקה גבוה יותר פי 40, פירוש הדבר שהאנזים פועל הרבה יותר מהר. על בסיס תגליות פונקציונליות אלה אפשר להציע דרכים תֵּרָפּוֹיְטִיּוֹת לטיפול במחלת האלצהיימר המבוססות על הרגולציה של הקונפורמציה המרחבית, בתיעדוף לפתוחה המתאפיינת בקנטיקה גבוהה, בכך להגדיל את הפירוק של צבר (אגרגטים) של עמילואיד-ביטא, ולהקדים תרופה למכה.
היבטים אבולוציוניים
Structural highlights
</StructureSection>