Human Insulin Degrading Enzyme (Hebrew)
From Proteopedia
| Line 21: | Line 21: | ||
<br> | <br> | ||
לאנזים יש שלוש <scene name='84/846755/Metal_binding_sites/1'>עמדות קישור</scene> המסומנות בבורדו (108 ,112 ,189) ליוני המתכת אבץ Zn+2, כלומר, שלושה אתרי קישור שונים, המהווים חלק מהאתר הפעיל הפרוטאוליטי בכל מונומר המרכיב את האנזים. בכל העמדות הללו מופיעה החומצה האמינית היסטידין (H)המכילה בשייר שלה קבוצה המכונה [https://en.wikipedia.org/wiki/Imidazole אימידזול] אשרה יכולה לקשור יוני מתכת (כדוגמת אבץ וניקל) בקשרים לא קוולנטים. עמדות אלו שמורות מבחינה אבולוציונית, כלומר גם ביצורים אחרים אשר מייצרים את האנזים מפרק האינסולין, עמדות הקישור למתכות זהות. | לאנזים יש שלוש <scene name='84/846755/Metal_binding_sites/1'>עמדות קישור</scene> המסומנות בבורדו (108 ,112 ,189) ליוני המתכת אבץ Zn+2, כלומר, שלושה אתרי קישור שונים, המהווים חלק מהאתר הפעיל הפרוטאוליטי בכל מונומר המרכיב את האנזים. בכל העמדות הללו מופיעה החומצה האמינית היסטידין (H)המכילה בשייר שלה קבוצה המכונה [https://en.wikipedia.org/wiki/Imidazole אימידזול] אשרה יכולה לקשור יוני מתכת (כדוגמת אבץ וניקל) בקשרים לא קוולנטים. עמדות אלו שמורות מבחינה אבולוציונית, כלומר גם ביצורים אחרים אשר מייצרים את האנזים מפרק האינסולין, עמדות הקישור למתכות זהות. | ||
| - | כחלק מהרגולציה על פעילות החלבון, נקשרת מולקולת ATP <scene name='84/846755/Atp_binding_site/2'>לעמדה 429</scene> המופיעה בכתום. בעמדה זו מופיעה החומצה האמינית ארגינין והיא שמורה אבולוציונית. הקישור של הATP לחלבון מוביל לשינוי בקונפורמציה המרחבית של החלבון החיונית לפעילות הקטאליטית שלו בפירוק הסובסטרט. | ||
<br> | <br> | ||
<scene name='84/846755/Substrate_binding_exosite/1'>עמדת הקישור לסוּבְּסְטְרָט</scene> (מוצגת במג'נטה) נמצאת בתוך תא קטליטי (catalytic chamber) שנוצר בעקבות התקפלות בכל אחד מהמונומרים של האנזים. התא הקטליטי הזה מתאפיין בשיירים בעלי מטען חשמלי חיובי, וכיוון שמטענו של אינוסלין הוא שלילי, המשיכה הכימית עולה בקונפורמציה זו. הרצף של עמדה זו (HLIGHEG) שמור אבולוציונית. התצמיד אנזים-סובסטרט משנה את הקונפורמציה המרחבית של הקומלקס, דבר שמאפשר את הפעילות הקטאליטית שמבצע האנזים (IDE) על הסובסטרט (אינסולין). | <scene name='84/846755/Substrate_binding_exosite/1'>עמדת הקישור לסוּבְּסְטְרָט</scene> (מוצגת במג'נטה) נמצאת בתוך תא קטליטי (catalytic chamber) שנוצר בעקבות התקפלות בכל אחד מהמונומרים של האנזים. התא הקטליטי הזה מתאפיין בשיירים בעלי מטען חשמלי חיובי, וכיוון שמטענו של אינוסלין הוא שלילי, המשיכה הכימית עולה בקונפורמציה זו. הרצף של עמדה זו (HLIGHEG) שמור אבולוציונית. התצמיד אנזים-סובסטרט משנה את הקונפורמציה המרחבית של הקומלקס, דבר שמאפשר את הפעילות הקטאליטית שמבצע האנזים (IDE) על הסובסטרט (אינסולין). | ||
<br> | <br> | ||
| + | פקטור נוסף שעושה רגולציה על המעבר מקונפורמציה פתוחה לסגורה היא רמת ה-ATP בתא. | ||
| + | כחלק מהרגולציה על פעילות החלבון, נקשרת מולקולת ATP <scene name='84/846755/Atp_binding_site/2'>לעמדה 429</scene> המופיעה בכתום. בעמדה זו מופיעה החומצה האמינית ארגינין והיא שמורה אבולוציונית. הקישור של הATP לחלבון מוביל לשינוי בקונפורמציה המרחבית של החלבון החיונית לפעילות הקטאליטית שלו בפירוק הסובסטרט. | ||
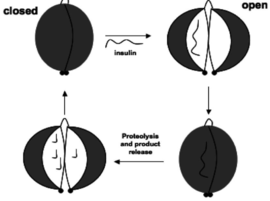
אם כן, לחלבון יש שתי קונפורמציות מרחביות; האחת סגורה, בה האתר הקושר סובסטרט סגור במין כיס הידרופובי ואינו מאפשר לתצמיד אנזים-סובסטרט להיווצר, והשניה פתוחה, בה האתר הפעיל חשוף יותר להיקשרות הסובסטרט, ומתאפשרת היקשרות של הסובסטרט לעמדות קושרות אבץ שנמצאות באתר הפעיל (ראו איור 2) | אם כן, לחלבון יש שתי קונפורמציות מרחביות; האחת סגורה, בה האתר הקושר סובסטרט סגור במין כיס הידרופובי ואינו מאפשר לתצמיד אנזים-סובסטרט להיווצר, והשניה פתוחה, בה האתר הפעיל חשוף יותר להיקשרות הסובסטרט, ומתאפשרת היקשרות של הסובסטרט לעמדות קושרות אבץ שנמצאות באתר הפעיל (ראו איור 2) | ||
| + | <br> | ||
[[Image:open and closed.PNG|thumb|270px|right|איור 2 - הקונפורמציה הפתוחה והסגורה של האנזים. כפי שניתן לראות, בקונפורנציה הסגורה, הסוסבסטרט אינו יכול להיקשר להאתר הפעיל הפרוטאוליטי, בעוד שבקונפורמציה הפתוחה רואים שהסובסטרט התפרק לחתיכות קטנות, הפפטיד התפרק.]]]] | [[Image:open and closed.PNG|thumb|270px|right|איור 2 - הקונפורמציה הפתוחה והסגורה של האנזים. כפי שניתן לראות, בקונפורנציה הסגורה, הסוסבסטרט אינו יכול להיקשר להאתר הפעיל הפרוטאוליטי, בעוד שבקונפורמציה הפתוחה רואים שהסובסטרט התפרק לחתיכות קטנות, הפפטיד התפרק.]]]] | ||
</p> | </p> | ||
Revision as of 11:13, 13 July 2020
אנזים מפרק אינסולין (Insulin-degrading enzyme, IDE) הוא פרוטאז, ששמו נגזר מתפקודו העיקרי בתא - לפרק את ההורמון הפפטידי אינסולין. הורמון האינסולין מופרש מבלוטת הלבלב כאשר הפונקציה המרכזית שלו היא לווסת את רמת הסוכר בדם על ידי הגדלת מספר התעלות לסוכר בתאי המטרה ובכך להגביר את ספיגת הגלוקוז על-ידם, כמו גם לעודד יצירת חומרי תשמורת (גליקוגן ושומן). להורמון אינסולין חשיבות מכרעת בתפקודו התקין של הגוף והיא מודגמת היטב במחלת סוכרת בה ישנה פגיעה בתפקוד או בהפרשת האינסולין לזרם הדם, מה שעלול להוביל למחלות מטאבוליות ולתופעות בריאותיות חמורות. הרגולציה על אינסולין בתיווכו של האנזים מפרק האינסולין יכולה אם כן לתרום להבנת המנגנון המבקר על תפקודו התקין של האינסולין וייתכן גם על דרכים תֵּרָפּוֹיְטִיּוֹת חדשות לטיפול במחלת הסכרת על כל סוגיה.
|
Contents |
מבנה
חלבון זה הוא למעשה דימר, המורכב משני מונומרים (מוצגות בתכלת ובורוד) המחוברים זה לזה בלולאה שאורכה 28 חומצות אמינו. שני המונומרים יכולים להיקשר זה לזה בקצוות שלהם ולשנות את הקונפורמציה המרחבית של האנזים (מפתוחה ולסגורה ולהפך, כפי שיתואר בהמשך).
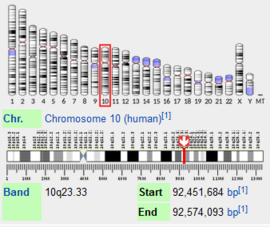
בבני אדם, הגן לאנזים זה נמצא בכרומוזום מס' 10, ואורכו עומד על 122,409 זוגות בסיסים, כאשר רצף זה מכיל 28 אקסונים. בעקבות שחבור חלופי, נוצרים לחלבון זה שני איזופורמים, האחד מכיל 1019 חומצות אמינו והנפוץ יותר, והשני קצר יותר ומכיל 464 חומצות אמינו. בערך זה נדבר על האיזופורם הגדול יותר, אשר משקלו המולקולרי עומד על כ-118kDa.
מבוסס על מבנים סלילניים המכונים helix - α (המופיעים בורוד), ומשטחי β הנקראים sheet – β (המופיעים בצהוב) וחיבורים מסתלסלים coiled coil (המופיעים בשחור). כאמור, בעקבות שחבור חלופי נוצרים שני איזופורמים שונים. החלבון הנוכחי הינו הארוך יותר, והוא מורכב מ1019 (כל הצבעים מייצגים חומצות אמינו שונות).
לאנזים יש שלוש המסומנות בבורדו (108 ,112 ,189) ליוני המתכת אבץ Zn+2, כלומר, שלושה אתרי קישור שונים, המהווים חלק מהאתר הפעיל הפרוטאוליטי בכל מונומר המרכיב את האנזים. בכל העמדות הללו מופיעה החומצה האמינית היסטידין (H)המכילה בשייר שלה קבוצה המכונה אימידזול אשרה יכולה לקשור יוני מתכת (כדוגמת אבץ וניקל) בקשרים לא קוולנטים. עמדות אלו שמורות מבחינה אבולוציונית, כלומר גם ביצורים אחרים אשר מייצרים את האנזים מפרק האינסולין, עמדות הקישור למתכות זהות.
(מוצגת במג'נטה) נמצאת בתוך תא קטליטי (catalytic chamber) שנוצר בעקבות התקפלות בכל אחד מהמונומרים של האנזים. התא הקטליטי הזה מתאפיין בשיירים בעלי מטען חשמלי חיובי, וכיוון שמטענו של אינוסלין הוא שלילי, המשיכה הכימית עולה בקונפורמציה זו. הרצף של עמדה זו (HLIGHEG) שמור אבולוציונית. התצמיד אנזים-סובסטרט משנה את הקונפורמציה המרחבית של הקומלקס, דבר שמאפשר את הפעילות הקטאליטית שמבצע האנזים (IDE) על הסובסטרט (אינסולין).
פקטור נוסף שעושה רגולציה על המעבר מקונפורמציה פתוחה לסגורה היא רמת ה-ATP בתא.
כחלק מהרגולציה על פעילות החלבון, נקשרת מולקולת ATP המופיעה בכתום. בעמדה זו מופיעה החומצה האמינית ארגינין והיא שמורה אבולוציונית. הקישור של הATP לחלבון מוביל לשינוי בקונפורמציה המרחבית של החלבון החיונית לפעילות הקטאליטית שלו בפירוק הסובסטרט.
אם כן, לחלבון יש שתי קונפורמציות מרחביות; האחת סגורה, בה האתר הקושר סובסטרט סגור במין כיס הידרופובי ואינו מאפשר לתצמיד אנזים-סובסטרט להיווצר, והשניה פתוחה, בה האתר הפעיל חשוף יותר להיקשרות הסובסטרט, ומתאפשרת היקשרות של הסובסטרט לעמדות קושרות אבץ שנמצאות באתר הפעיל (ראו איור 2)
פונקציות וחשיבות קלינית
האנזים מפרק האינסולין אובחן לראשונה בשנת 1949 כבעל היכולת לפרק את ההורמון אינסולין (ומכאן אפוא נגזר שמו). הסובסטרט אינסולין מורכב משתי שרשרות פוליפפטידיות; שרשרת ה-A הבנויה מ-21 חומצות אמינו ושרשרת ה-B הבנויה מ-30 חומצות אמינו. שתי השרשרות מחוברות באמצעות קשרים די-סולפידיים ומקופלות יחד (ולמרות זאת, מעניין לציין שהאנזים אינו מפרק את הקשרים האלו בקטליזה של אינסולין!). בשנת 1988 התגלה כי אנזים זה חותך באופן ספציפי את שרשרת B של ההורמון אינסולין. לאחר מכן, בהשוואה שעשו עם פרוטאזות שונות התגלה שאנזים זה מסוגל לבצע פעילות קטאליטית על סובסטרטים שונים, ביניהם ההורמונים גלוקגון (אנטגוניסט לאינסולין), TFG-alpha וביטא אנדרופין, אך האנזים מתאפיין באפיניות הגבוהה ביותר לאינסולין. בנוסף לרגולציה על הורמונים אלו, בשנת 1994 הראו כי לאנזים IDE יש תפקיד גם בפירוק של החלבון עמילואיד-ביטא, חלבון שהצטברותו (אגרגציה) בתא נמצאת בקורלציה עם מחלת האלצהיימר. מניסויים גנטיים על עכברים עולה כי גם קיימת קורלציה למחלה המטאבולית סכרתת סוג 2. בניסויים אלו עשו נוקאוט גנטי לגן IDE ויצרו עכברים עםמוטציות חסר אשר אינם מסוגלים לייצר את האנזים. אצל עכברים טראנסגנים אלו הולך ומצטבר אינסולין לאורך זמן (כיוון שאין מי שיפרק אותו ויבקר את רמתו), מצב המכונה היפראינסולינמיה ובסופו של דבר נוצר מצב של לאי סבילות לגלוקוז, המאפיין את מחלת הסכרת.
למרות שרב הנסתר על הגלוי באשר למכניזם שמסביר את הקטליזה אותה מבצע האנזים, נמצא כי שלב קובע מהירות מותנה התקפה נוקלאופילית שמתרחשת כאשר יוני האבץ עוברים לסובסטרט. כפי שהוזכר, לחלבון זה שתי קונפורמציות מרחביות, כאשר הפתוחה מאפשרת קישור של הסובסטרט לעמדות קושרות אבץ שנמצאות באתר הפעיל. לפיכך, הפקטורים שמייצבים את הקונפורמציה הסגורה משפיעים על השלב קובע המהירות.
נמצא כי מוטציות באזורים ספציפים בחלבון יכולים להוביל לתעדוף של הקונפורמציה הפתוחה, מה שהוביל לקינטיקה גבוה יותר פי 40, פירוש הדבר שהאנזים פועל הרבה יותר מהר. על בסיס תגליות פונקציונליות אלה אפשר להציע דרכים תֵּרָפּוֹיְטִיּוֹת לטיפול במחלת האלצהיימר ובסכרת סוג 2 המבוססות על הרגולציה של הקונפורמציה המרחבית, בתיעדוף לפתוחה המתאפיינת בקנטיקה גבוהה, בכך להגדיל את הפירוק של אינסולין וצבר (אגרגטים) של עמילואיד-ביטא, ולהקדים תרופה למכה.
היבטים אבולוציוניים
Structural highlights
</StructureSection>