Cytochrome C (Hebrew)
From Proteopedia
(Difference between revisions)
| Line 11: | Line 11: | ||
<br> | <br> | ||
[https://youtu.be/LQmTKxI4Wn4 סרטון] נוסף מסביר על התהליך בזווית רחבה יותר(ללא תרגום לעברית) | [https://youtu.be/LQmTKxI4Wn4 סרטון] נוסף מסביר על התהליך בזווית רחבה יותר(ללא תרגום לעברית) | ||
| - | + | <br> | |
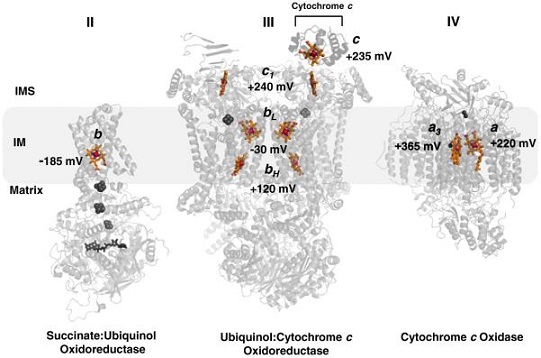
בשרשרת הולכת האלקטרונים ציטוכרום C מעביר אלקטרון בין קומפלקסי הנשימה III ו-IV; קומפלקס III נקרא ציטוכרום bc1 וקומפלקס-IV נקרא ציטוכרום C אוקסידאז. מעבר האלקטרונים מתאפשר עקב מצב חמצון משתנה של אטום הברזל. בתחילה, יון הברזל בקבוצת ההם בציטוכרום C נמצא במצב מופחת, Fe3+; זה מאפשר קליטה של אלקטרון אחד ומחמצן את הברזל למצב Fe2+. | בשרשרת הולכת האלקטרונים ציטוכרום C מעביר אלקטרון בין קומפלקסי הנשימה III ו-IV; קומפלקס III נקרא ציטוכרום bc1 וקומפלקס-IV נקרא ציטוכרום C אוקסידאז. מעבר האלקטרונים מתאפשר עקב מצב חמצון משתנה של אטום הברזל. בתחילה, יון הברזל בקבוצת ההם בציטוכרום C נמצא במצב מופחת, Fe3+; זה מאפשר קליטה של אלקטרון אחד ומחמצן את הברזל למצב Fe2+. | ||
[[Image:Cytochrome C Oxydoreductase.jpg]] | [[Image:Cytochrome C Oxydoreductase.jpg]] | ||
==<div style="text-align: right;">מבנה המולקולה </div> == | ==<div style="text-align: right;">מבנה המולקולה </div> == | ||
| - | + | <p dir='rtl'> | |
| - | + | ציטוכרום C משתייך למשפחת חלבונים בשם all-α proteins, המאופיינים בליבה העשויה מהמבנה השניוני אלפא הליקס (בלבד). כל חלבון במשפחת-על זו מכיל גם קבוצת הם אחת או יותר. קבוצת ההם קשורה קוולנטית לחלבון. (לצרף סצנה של מבנה שניוני) | |
<br> | <br> | ||
| + | ציטוכרום C אנושי בנוי מרצף של 104 חומצות אמינו. שתי חומצות אמינו קושרות קוולנטית את אטום הברזל (היסטדין בעמדה 18 ומתיונין בעמדה 80) (לצרף סצנה), שתי חומצות אמינו נקשרות קוולנטית לקבוצת ההם (ציסטאין בעמדה 17 וציסטאין בעמדה 14 )לצרף סצנה . | ||
| + | <br> | ||
| + | נמצא שיש מוטיב של מספר חומצות אמינו השמור מבחינה אבולוציונית. הכולל בתוכו את חומצות האמינו החשובות לקישור אטום הברזל וקבוצת ההם. CXXCH (היסטדין, ציסטאין, X, X, ציסטאין) כאשר X יכולה להיות כל חומצה אמינית שהיא איננה ציסטאין. ניתן לראות שגם בחלבון ציטוכרום C באדם ישנה את אותה התבנית. (להוסיף סצנה של מידת שימור אבולוציוני) | ||
| + | <br> | ||
| + | HEME C - קבוצת ההם הינה תרכובת אורגנית המיוצרת במח העצם ובכבד, קבוצה פרוסתטית - תרכובת קטנה המהווה חלק מחלבון. פעולותיה הפיזיולוגיות של קבוצת ההם נובעות מיכולתו של אטום הברזל לקשור מולקולות קטנות (מולקולה דו-אטומית של חמצן, למשל), וכן לחזר ולחמצן (לתרום אלקטרונים ולקבל אלקטרונים, בהתאמה) תרכובות אחרות. | ||
| + | <br> | ||
| + | מודיפיקציות לאחר תרגום - זרחון Tyr בעמדה 48 מקנה לחלבון פעילות אנטי אפופטוטית (לצרף סצנה) | ||
| + | </p> | ||
<scene name='89/898985/Hem_c/1'>קבוצת הם</scene> | <scene name='89/898985/Hem_c/1'>קבוצת הם</scene> | ||
<br> | <br> | ||
| Line 23: | Line 31: | ||
<br> | <br> | ||
<scene name='89/898985/Secondary_structure/1'>מבנה שניוני</scene> | <scene name='89/898985/Secondary_structure/1'>מבנה שניוני</scene> | ||
| - | <br> | ||
<scene name='89/898985/Evolutionary_conservation/1'>שמירות אבולוציונית</scene> | <scene name='89/898985/Evolutionary_conservation/1'>שמירות אבולוציונית</scene> | ||
==<div style="text-align: right;">תפקוד </div> == | ==<div style="text-align: right;">תפקוד </div> == | ||
| - | + | <p dir='rtl'> | |
| - | < | + | טקסט טקסט טקסט |
| - | + | </p> | |
==<div style="text-align: right;">פעילות אפופטוזית </div>== | ==<div style="text-align: right;">פעילות אפופטוזית </div>== | ||
<p dir='rtl'> | <p dir='rtl'> | ||
לציטוכרום C תפקיד נוסף וחשוב בתהליך מוות מבוקר של התא (תהלי המכונה אפופטוזיס). תהליך זה מאפשר התפתחות איברים תקינה בשלב ההתפתחות העוברית , אחראי לסלקציה של תאי דם לבנים, להרג תאים סרטניים או חולים ולהרג של תאים זקנים. | לציטוכרום C תפקיד נוסף וחשוב בתהליך מוות מבוקר של התא (תהלי המכונה אפופטוזיס). תהליך זה מאפשר התפתחות איברים תקינה בשלב ההתפתחות העוברית , אחראי לסלקציה של תאי דם לבנים, להרג תאים סרטניים או חולים ולהרג של תאים זקנים. | ||
| + | <br> | ||
| + | ב [https://youtu.be/Od3pUsVdMhQ סרטון] הבא מתואר תהליך המוות המבוקר, ניתן לראות כיצד ציטוכרום סי קשור בתהליך. מתורגם לעברית | ||
| + | <br> | ||
| + | כאשר ציטוכרום C מתפקד כנשא אלקטרונים הוא מעוגן לממברנה הפנימית של המיטוכונדריה באמצעות קשר הידרופובי לפוסופליפיד קרדיוליפין (מולקולה הידרופובית הבונה את הממברנה של המיטוכונדריה). | ||
| + | <br> | ||
| + | תחילת תהליך המוות התאי מאופיינת בעלייה של רדיקלים חופשיים (ROS) במיטוכונדריה. כתוצאה מכך, קרדיוליפין מתחמצן והקומפלקס קרדיוליפין-ציטוכרום C נפרד. ציטוכרום C מנותק מהממברנה הפנימית של המיטוכונדריה ועובר דרך נקבוביות בממברנה החיצונית אל הציטופלזמה. בציטופלזמה ציטוכרום C נקשר לחלבון APAF1 וביחד עם dATP נוצר מכלול הקושר ומבקע את החלבון פרוקספאז 9 לצורתו הבוגרת והפעילה. בכך מתאפשר חיבור עם קספאזות 3 ו- 7 ליצירת מבנה האפופטוזום. מבנה זה מפעיל את המסלול האפופטוטי הפנימי המסתיים במוות מכוון של התא (המבנה מפרק את תוכנו של התא). | ||
</p> | </p> | ||
| - | ב [https://youtu.be/Od3pUsVdMhQ סרטון] מתואר תהליך המוות המבוקר, ניתן לראות כיצד ציטוכרום סי קשור בתהליך. מתורגם לעברית | ||
| - | |||
==<div style="text-align: right;">מניעת אפופטוזה </div> == | ==<div style="text-align: right;">מניעת אפופטוזה </div> == | ||
| + | <p dir='rtl'> | ||
| + | אחת הדרכים שבהן מופעל אפופטוזיס התא היא על ידי שחרור ציטוכרום c מהמיטוכונדריה אל הציטוזול. מחקר הראה שתאים מסוגלים להגן על עצמם מפני אפופטוזיס על ידי חסימת השחרור של ציטוכרום C באמצעות Bcl-xL (חלבון המונע את חדירות הממברנה ולכן את יציאת ציטוכרום C לציטוזול. ככל שהכמות של החלבון תעלה כך תעלה פעילותו המונעת מוות תאי). התגלתה דרך נוספת שבה תאים יכולים לשלוט באפופטוזיס והיא על ידי מודיפקציה לאחר תרגום בחלבון. זרחון Tyr בעמדה 48 מקנה לחלבון פעילות אנטי אפופטוטית. | ||
<br> | <br> | ||
| - | + | להוסיף קישור | |
| + | <br> | ||
| + | פעילותו כנוגד חמצון (מפחית ROS) ובכך מונע את שחרורו שלו מהממברנה הפנימית- | ||
| + | מחקר שנערך לאחרונה הראה שהוא יכול לשמש גם כאנזים נוגד חמצון במיטוכונדריה; והוא עושה זאת על ידי הסרת סופראוקסיד (O2–) ומי חמצן (H2O2) מהמיטוכונדריה לפי התרשים הבא- | ||
| + | </p> | ||
==<div style="text-align: right;">גנטיקה </div> == | ==<div style="text-align: right;">גנטיקה </div> == | ||
<br> | <br> | ||
Revision as of 06:38, 4 January 2022
C ציטוכרום
| |||||||||||
Proteopedia Page Contributors and Editors (what is this?)
Rachel Krucker, Nitzan Hodorov Keinan, Fatima M Hameed, Michal Harel