DD-transpeptidase (Hebrew)
From Proteopedia
(Difference between revisions)
| Line 20: | Line 20: | ||
[[Image:Peptide bond peptidoglycan.JPG|300 px|thumb|left|מבנה הפפטידוגליקן]] | [[Image:Peptide bond peptidoglycan.JPG|300 px|thumb|left|מבנה הפפטידוגליקן]] | ||
<p dir='rtl'> | <p dir='rtl'> | ||
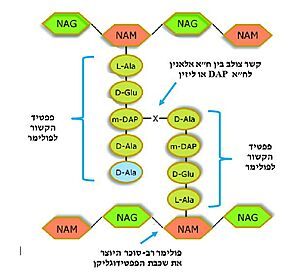
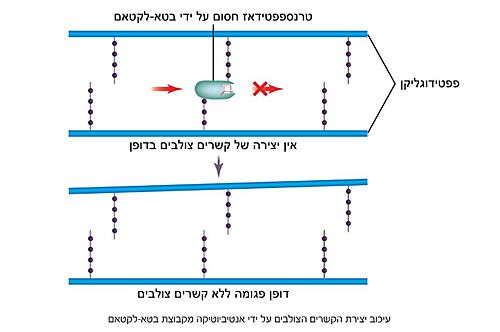
| - | האנזים טרנספפטידאז מעורב בבניית הדופן בתאי חיידקים, בזמן חלוקת התא. דופן התא היא מבנה קשיח המצוי מסביב לקרום תא החיידק, ובנוי ממולקולות פפטידוגליקן; פולימרים של רב-סוכר המחוברים בינהם בפפטידים קצרים. הפפטידים בין שכבות הפולימרים הרב-סוכריים נקשרים זה לזה בקשרים צולבים ומקנים לדופן מבנה תלת מימדי, יציב וקשיח. האנזים טרנספפטידאז אחראי על יצירת הקשרים הצולבים בין הפפטידים של שכבות הפפטידוגליקן<ref name="WIEZMANN">[https://bioteach.org.il/%D7%A2%D7%9C%D7%95%D7%A0%D7%99%D7%9D-2002/%D7%AA%D7%95%D7%9B%D7%9F-%D7%A2%D7%99%D7%95%D7%A0%D7%99/%D7%A0%D7%95%D7%A9%D7%90%D7%99-%D7%94%D7%A2%D7%9E%D7%A7%D7%94-1/%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D/%D7%9E%D7%A7%D7%95%D7%A8%D7%95%D7%AA-%D7%9E%D7%99%D7%93%D7%A2-22/3573-%D7%A1%D7%A4%D7%A8-%D7%93%D7%99%D7%92%D7%99%D7%98%D7%9C%D7%99-%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D-2016 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016]</ref>. תגובה זו מתרחשת באתר הפעיל של האנזים, שבו חומצה אמינית סרין נקשרת לחומצה אמינית אלאנין הנמצאת בקצה הפפטיד בסובסטראט. האנזים מזרז את יצירת הקשר הפפטידי (סוג של [https://youtu.be/NgD9yHSJ29I?t=72 קשר קוולנטי] הנוצר בין חומצות אמינו) עם חומצת אמינו ליזין (בחיידקים גראם-חיוביים) או עם חומצת אמינו מסוג DAP (קיצור של: Diaminopimelic acid, בחיידקים גראם-חיוביים) הנמצאות בעמדה השלישית מהסוף בפפטיד המחובר לפולימר הסמוך. באופן זה נוצרים קשרים צולבים בין שכבות סמוכות בפפטידוגליקן, המקנים לדופן מבנה קשיח ויציב העמיד בפני לחץ אוסמוטי | + | האנזים טרנספפטידאז מעורב בבניית הדופן בתאי חיידקים, בזמן חלוקת התא. דופן התא היא מבנה קשיח המצוי מסביב לקרום תא החיידק, ובנוי ממולקולות פפטידוגליקן; פולימרים של רב-סוכר המחוברים בינהם בפפטידים קצרים. הפפטידים בין שכבות הפולימרים הרב-סוכריים נקשרים זה לזה בקשרים צולבים ומקנים לדופן מבנה תלת מימדי, יציב וקשיח. האנזים טרנספפטידאז אחראי על יצירת הקשרים הצולבים בין הפפטידים של שכבות הפפטידוגליקן<ref name="WIEZMANN">[https://bioteach.org.il/%D7%A2%D7%9C%D7%95%D7%A0%D7%99%D7%9D-2002/%D7%AA%D7%95%D7%9B%D7%9F-%D7%A2%D7%99%D7%95%D7%A0%D7%99/%D7%A0%D7%95%D7%A9%D7%90%D7%99-%D7%94%D7%A2%D7%9E%D7%A7%D7%94-1/%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D/%D7%9E%D7%A7%D7%95%D7%A8%D7%95%D7%AA-%D7%9E%D7%99%D7%93%D7%A2-22/3573-%D7%A1%D7%A4%D7%A8-%D7%93%D7%99%D7%92%D7%99%D7%98%D7%9C%D7%99-%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D-2016 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016]</ref>. תגובה זו מתרחשת באתר הפעיל של האנזים, שבו חומצה אמינית סרין נקשרת לחומצה אמינית אלאנין הנמצאת בקצה הפפטיד בסובסטראט. האנזים מזרז את יצירת הקשר הפפטידי (סוג של [https://youtu.be/NgD9yHSJ29I?t=72 קשר קוולנטי] הנוצר בין חומצות אמינו) עם חומצת אמינו ליזין (בחיידקים גראם-חיוביים) או עם חומצת אמינו מסוג DAP (קיצור של: Diaminopimelic acid, בחיידקים גראם-חיוביים) הנמצאות בעמדה השלישית מהסוף בפפטיד המחובר לפולימר הסמוך. באופן זה נוצרים קשרים צולבים בין שכבות סמוכות בפפטידוגליקן, המקנים לדופן מבנה קשיח ויציב העמיד בפני לחץ אוסמוטי <ref name="PUBMED2">[https://pubmed.ncbi.nlm.nih.gov/14692773/ A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins]</ref>. |
[[Image:Cross link peptidoglycan.jpg|500 px|יצירת הקשר הפפטידי]] | [[Image:Cross link peptidoglycan.jpg|500 px|יצירת הקשר הפפטידי]] | ||
</p> | </p> | ||
| Line 30: | Line 30: | ||
<p dir='rtl'> | <p dir='rtl'> | ||
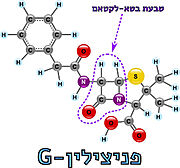
[https://www.hamichlol.org.il/%D7%A4%D7%A0%D7%99%D7%A6%D7%99%D7%9C%D7%99%D7%9F פניצילין] הוא שם כולל לקבוצת חומרים אנטיביוטיים המעכבים את תהליך יצירת דופן התא על ידי עיכוב האנזים טרנספפטידאז. הפניצילין התגלה על ידי [https://davidson.weizmann.ac.il/online/sciencehistory/%D7%94%D7%99%D7%95%D7%9D-%D7%9C%D7%A4%D7%A0%D7%99-%D7%90%D7%9C%D7%9B%D7%A1%D7%A0%D7%93%D7%A8-%D7%A4%D7%9C%D7%9E%D7%99%D7%A0%D7%92 אלכסנדר פלמינג] בשנת 1928, ובהמשך פותחה הטכנולוגיה המאפשרת להפיק את החומר מפטריית העובש [https://www.familyhandyman.com/article/what-to-know-about-penicillium-mold/ פניציליום]. כיום ניתן לייצר גם פניצילינים סינתטיים-למחצה, כאשר המשותף לכל סוגי הפניצילינים הוא קיומה של מבנה טבעת הבטא-לקטם במולקולה; מבנה טבעתי המכיל 3 אטומי פחמן ואטום חנקן אחד (4) (5). | [https://www.hamichlol.org.il/%D7%A4%D7%A0%D7%99%D7%A6%D7%99%D7%9C%D7%99%D7%9F פניצילין] הוא שם כולל לקבוצת חומרים אנטיביוטיים המעכבים את תהליך יצירת דופן התא על ידי עיכוב האנזים טרנספפטידאז. הפניצילין התגלה על ידי [https://davidson.weizmann.ac.il/online/sciencehistory/%D7%94%D7%99%D7%95%D7%9D-%D7%9C%D7%A4%D7%A0%D7%99-%D7%90%D7%9C%D7%9B%D7%A1%D7%A0%D7%93%D7%A8-%D7%A4%D7%9C%D7%9E%D7%99%D7%A0%D7%92 אלכסנדר פלמינג] בשנת 1928, ובהמשך פותחה הטכנולוגיה המאפשרת להפיק את החומר מפטריית העובש [https://www.familyhandyman.com/article/what-to-know-about-penicillium-mold/ פניציליום]. כיום ניתן לייצר גם פניצילינים סינתטיים-למחצה, כאשר המשותף לכל סוגי הפניצילינים הוא קיומה של מבנה טבעת הבטא-לקטם במולקולה; מבנה טבעתי המכיל 3 אטומי פחמן ואטום חנקן אחד (4) (5). | ||
| - | טבעת הבטא-לקטם דומה במבנה המרחבי ובהרכבה הכימי לצמד חומצות האמינו אלאנין המצויות בקצה הפפטיד בדופן הפפטידוגליקן. דמיון זה מאפשר לטבעת הבטא-לקטם להיקשר לחומצה האמינית סרין הממוקמת באתר הפעיל של האנזים טרנספפטידאז. עם זאת, בניגוד לתגובה המתרחשת בין הפפטיד לטרנספפטידאז המאפשרת את יצירת הקשר הצולב והתנתקות של האנזים לאחר מכן, טבעת הבטא-לקטם נפתחת ויוצרת קשר קוולנטי עם הח"א סרין שבאתר הפעיל, ובכך מעכבת את פעילות האנזים באופן [https://sites.google.com/site/enzymeinh/def/inh/rev בלתי הפיך]. מכיוון שטבעת הבטא-לקטם במולקולת הפניצילין נקשרת לאתר הפעיל באנזים, היא נחשבת ל[https://www.youtube.com/watch?v=sByPvdzUNsU&ab_channel=%D7%9E%D7%9B%D7%95%D7%9F%D7%93%D7%95%D7%99%D7%93%D7%A1%D7%95%D7%9F-%D7%A1%D7%A8%D7%98%D7%95%D7%A0%D7%99%D7%9E%D7%93%D7%A2 מעכב תחרותי] המתחרה עם הפפטידוגליקן (הסובסטראט) על הקישור לאתר הפעיל | + | טבעת הבטא-לקטם דומה במבנה המרחבי ובהרכבה הכימי לצמד חומצות האמינו אלאנין המצויות בקצה הפפטיד בדופן הפפטידוגליקן. דמיון זה מאפשר לטבעת הבטא-לקטם להיקשר לחומצה האמינית סרין הממוקמת באתר הפעיל של האנזים טרנספפטידאז. עם זאת, בניגוד לתגובה המתרחשת בין הפפטיד לטרנספפטידאז המאפשרת את יצירת הקשר הצולב והתנתקות של האנזים לאחר מכן, טבעת הבטא-לקטם נפתחת ויוצרת קשר קוולנטי עם הח"א סרין שבאתר הפעיל, ובכך מעכבת את פעילות האנזים באופן [https://sites.google.com/site/enzymeinh/def/inh/rev בלתי הפיך]. מכיוון שטבעת הבטא-לקטם במולקולת הפניצילין נקשרת לאתר הפעיל באנזים, היא נחשבת ל[https://www.youtube.com/watch?v=sByPvdzUNsU&ab_channel=%D7%9E%D7%9B%D7%95%D7%9F%D7%93%D7%95%D7%99%D7%93%D7%A1%D7%95%D7%9F-%D7%A1%D7%A8%D7%98%D7%95%D7%A0%D7%99%D7%9E%D7%93%D7%A2 מעכב תחרותי] המתחרה עם הפפטידוגליקן (הסובסטראט) על הקישור לאתר הפעיל <ref name="PUBMED2">[https://pubmed.ncbi.nlm.nih.gov/14692773/ A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins]</ref>. |
</p> | </p> | ||
<br> | <br> | ||
Revision as of 07:48, 18 January 2022
טרנספפטידאז
| |||||||||||
ביבליוגרפיה
- ↑ PDB
- ↑ UNIPROT
- ↑ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution
- ↑ Wikipedia: DD-transpeptidase
- ↑ 5.0 5.1 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016
- ↑ 6.0 6.1 A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins