DD-transpeptidase (Hebrew)
From Proteopedia
(Difference between revisions)
| Line 18: | Line 18: | ||
===<div style="text-align:right;direction:rtl;">'''תפקוד החלבון'''</div>=== | ===<div style="text-align:right;direction:rtl;">'''תפקוד החלבון'''</div>=== | ||
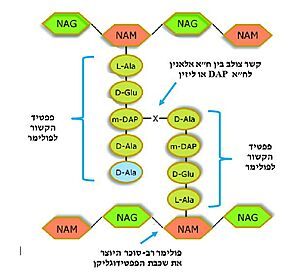
| - | [[Image:Peptide bond peptidoglycan.JPG|300 px|thumb|left|מבנה הפפטידוגליקן]] | + | [[Image:Peptide bond peptidoglycan.JPG|300 px|thumb|left|תמונה מס. 2: מבנה הפפטידוגליקן]] |
<p dir='rtl'> | <p dir='rtl'> | ||
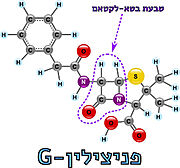
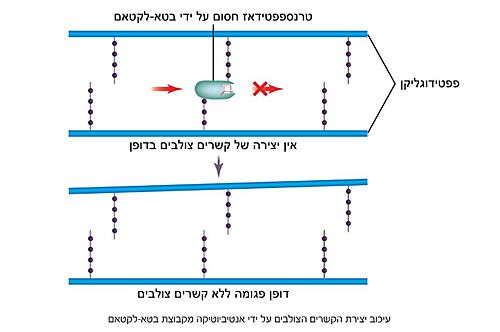
| - | האנזים טרנספפטידאז מעורב בבניית הדופן בתאי חיידקים, בזמן חלוקת התא. דופן התא היא מבנה קשיח המצוי מסביב לקרום תא החיידק, ובנוי ממולקולות פפטידוגליקן; פולימרים של רב-סוכר המחוברים בינהם בפפטידים קצרים. הפפטידים בין שכבות הפולימרים הרב-סוכריים נקשרים זה לזה בקשרים צולבים ומקנים לדופן מבנה תלת מימדי, יציב וקשיח. האנזים טרנספפטידאז אחראי על יצירת הקשרים הצולבים בין הפפטידים של שכבות הפפטידוגליקן<ref name="WIEZMANN">[https://bioteach.org.il/%D7%A2%D7%9C%D7%95%D7%A0%D7%99%D7%9D-2002/%D7%AA%D7%95%D7%9B%D7%9F-%D7%A2%D7%99%D7%95%D7%A0%D7%99/%D7%A0%D7%95%D7%A9%D7%90%D7%99-%D7%94%D7%A2%D7%9E%D7%A7%D7%94-1/%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D/%D7%9E%D7%A7%D7%95%D7%A8%D7%95%D7%AA-%D7%9E%D7%99%D7%93%D7%A2-22/3573-%D7%A1%D7%A4%D7%A8-%D7%93%D7%99%D7%92%D7%99%D7%98%D7%9C%D7%99-%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D-2016 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016]</ref>. תגובה זו מתרחשת באתר הפעיל של האנזים, שבו חומצה אמינית סרין נקשרת לחומצה אמינית אלאנין הנמצאת בקצה הפפטיד בסובסטראט. האנזים מזרז את יצירת הקשר הפפטידי (סוג של [https://youtu.be/NgD9yHSJ29I?t=72 קשר קוולנטי] הנוצר בין חומצות אמינו) עם חומצת אמינו ליזין (בחיידקים גראם-חיוביים) או עם חומצת אמינו מסוג DAP (קיצור של: Diaminopimelic acid,זוהי חומצה אמינית לא שגרתית והיא נגזרת של החומצה האמינית ליזין בחיידקים גראם-חיוביים) הנמצאות בעמדה השלישית מהסוף בפפטיד המחובר לפולימר הסמוך. באופן זה נוצרים קשרים צולבים בין שכבות סמוכות בפפטידוגליקן, המקנים לדופן מבנה קשיח ויציב העמיד בפני לחץ אוסמוטי <ref name="PUBMED2">[https://pubmed.ncbi.nlm.nih.gov/14692773/ A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins]</ref>. | + | האנזים טרנספפטידאז מעורב בבניית הדופן בתאי חיידקים, בזמן חלוקת התא. דופן התא היא מבנה קשיח המצוי מסביב לקרום תא החיידק, ובנוי ממולקולות פפטידוגליקן; פולימרים של רב-סוכר המחוברים בינהם בפפטידים קצרים. הפפטידים בין שכבות הפולימרים הרב-סוכריים נקשרים זה לזה בקשרים צולבים ומקנים לדופן מבנה תלת מימדי, יציב וקשיח. האנזים טרנספפטידאז אחראי על יצירת הקשרים הצולבים בין הפפטידים של שכבות הפפטידוגליקן<ref name="WIEZMANN">[https://bioteach.org.il/%D7%A2%D7%9C%D7%95%D7%A0%D7%99%D7%9D-2002/%D7%AA%D7%95%D7%9B%D7%9F-%D7%A2%D7%99%D7%95%D7%A0%D7%99/%D7%A0%D7%95%D7%A9%D7%90%D7%99-%D7%94%D7%A2%D7%9E%D7%A7%D7%94-1/%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D/%D7%9E%D7%A7%D7%95%D7%A8%D7%95%D7%AA-%D7%9E%D7%99%D7%93%D7%A2-22/3573-%D7%A1%D7%A4%D7%A8-%D7%93%D7%99%D7%92%D7%99%D7%98%D7%9C%D7%99-%D7%97%D7%99%D7%99%D7%93%D7%A7%D7%99%D7%9D-%D7%95%D7%A0%D7%92%D7%99%D7%A4%D7%99%D7%9D-%D7%91%D7%92%D7%95%D7%A3-%D7%94%D7%90%D7%93%D7%9D-2016 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016]</ref>. תגובה זו מתרחשת באתר הפעיל של האנזים, שבו חומצה אמינית סרין נקשרת לחומצה אמינית אלאנין הנמצאת בקצה הפפטיד בסובסטראט. האנזים מזרז את יצירת הקשר הפפטידי (סוג של [https://youtu.be/NgD9yHSJ29I?t=72 קשר קוולנטי] הנוצר בין חומצות אמינו) עם חומצת אמינו ליזין (בחיידקים גראם-חיוביים) או עם חומצת אמינו מסוג DAP (קיצור של: Diaminopimelic acid,זוהי חומצה אמינית לא שגרתית והיא נגזרת של החומצה האמינית ליזין בחיידקים גראם-חיוביים) הנמצאות בעמדה השלישית מהסוף בפפטיד המחובר לפולימר הסמוך (תמונה מס. 2). באופן זה נוצרים קשרים צולבים בין שכבות סמוכות בפפטידוגליקן, המקנים לדופן מבנה קשיח ויציב העמיד בפני לחץ אוסמוטי <ref name="PUBMED2">[https://pubmed.ncbi.nlm.nih.gov/14692773/ A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins]</ref>. |
[[Image:Cross link peptidoglycan.jpg|500 px|יצירת הקשר הפפטידי]] | [[Image:Cross link peptidoglycan.jpg|500 px|יצירת הקשר הפפטידי]] | ||
</p> | </p> | ||
Revision as of 08:13, 25 January 2022
טרנספפטידאז
| |||||||||||
ביבליוגרפיה
- ↑ PDB
- ↑ UNIPROT
- ↑ The refined crystallographic structure of a DD-peptidase penicillin-target enzyme at 1.6 A resolution
- ↑ Wikipedia: DD-transpeptidase
- ↑ 5.0 5.1 כהנא, אורה. חיידקים ונגיפים בגוף האדם, 2016
- ↑ 6.0 6.1 A mechanism-based inhibitor targeting the DD-transpeptidase activity of bacterial penicillin-binding proteins
- ↑ ויקיפדיה: פניצילין
- ↑ ויקיפדיה: לקטאם