טבלה 1

מבנה האנזים
BamHI הוא דימר סימטרי(תמונה 1). ה- נקשר בחריץ גדול שנוצר בין דימרים, האנזים נקשר בצורה "מוצלבת".
הקשר בין חלבון לבסיסים הוא באמצעות קשרי מימן ישירים או קשרי H בתיווך מים בין החלבון לכל קבוצה תורמת/מקבלת קשרי H בחריץ הראשי.
BamH1 שמקורו בחיידקי Bacillus amyloliquefaciens הוא , צורת האנזים כשאינו במצב קשירה כמשטח β מוקף
. הדבר היוצא דופן והייחודי במולקולת האנזים הוא זה שהיא עוברת שינויים מבניים לא שגרתיים בעת קשירה ל DNA ובכך מבנה ה DNA נשמר תקין ולא עובר עיוות דבר שמסייע לקשירת האנזים.
באנזים BamHIמשטחי מוקפים ע"י סלילי α בקצה האחד של פיתול β, יש שלושה שיירים קטליטיים (Asp94, Glu111 ו-Glu113 ) שהם מהווים ביחד את של האנזים בסצנה רואים את ה DNA (באדום) נקשר לאתר הפעיל של האנזים בחומצות אמינו Asp94, Glu111 ו-Glu113 (מסומנות בירוק בדימר אחד ובכחול בדימר השני). שלושת חומצות האמינו האלו באנזים קושרות יון מגנזיום שפועל כקו פקטור.
BamHI הוא דימר סימטרי. ה- DNA נקשר בחריץ גדול שנוצר בין דימרים, האנזים נקשר בצורה "מוצלבת".
הקשר בין חלבון לבסיסים הוא באמצעות קשרי מימן ישירים או קשרי H בתיווך מים בין החלבון לכל קבוצה תורמת/מקבלת קשרי H בחריץ הראשי.
כשהאנזים BamHI נקשר למולקולת DNA הוא עובר סדרה של שינויים מבניים ייחודיים. השינוי העיקרי כרוך בסליל α בקצה הקרבוקסילי של כל תת-יחידה. בצורת האנזים החופשי שאינו קשור ל DNA, אזורים אלה מסודרים, אך עם קשירת ה-DNA הסלילים הללו מתפרקים, ומקבלים מבנה משני סלילי לא מסודר חלקית, המכונה זרוע, דבר שגורם להתאמה בין ה DNA והאנזים.
שינוי נוסף המתרחש עם קישור BamHI-DNA הוא שינוי במבנה הרבעוני של האנזים. פעולה זו "מצמידה" את ה-DNA לאנזים וגורמת ליצור מגעים רבים עם עמוד השדרה של ה DNA (השרשראות של הסוכרים).
אנזים BamH1 מזהה הרצף הדו גדילי 3 -GGATCC-5 ונקשר איליו ומבקע הרצפים האלה אחרי הנוקלאוטיד 5-גאונין בכל גדיל ( G|GATCC) ,ע"י פירוק הקשר הפוספו-דיאסתירי בינו לבין הגאונין שאחריו, חיתוך זה נקרא חיתוך מדורג. כתוצאה מכך ייווצרו קצוות דביקים אורכם 4 נוקלאוטידים שיש להם נטייה להיצמד לחד גדילי בעל רצף משלים.
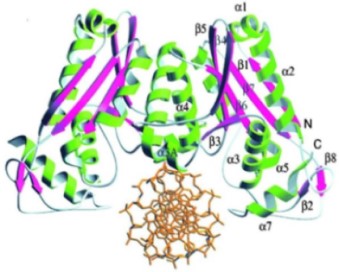
תמונה 1: הדימר הסימטרי של אנזים BamHI.
כשהאנזים BamHI נקשר למולקולת DNA הוא עובר סדרה של שינויים מבניים ייחודיים. השינוי העיקרי כרוך בסליל α בקצה הקרבוקסילי של כל תת-יחידה. בצורת האנזים החופשי שאינו קשור ל DNA, אזורים אלה מסודרים, אך עם קשירת ה-DNA הסלילים הללו מתפרקים, ומקבלים מבנה משני סלילי לא מסודר חלקית, המכונה זרוע, דבר שגורם להתאמה בין ה DNA והאנזים.
שינוי נוסף המתרחש עם קישור BamHI-DNA הוא שינוי במבנה הרבעוני של האנזים. פעולה זו "מצמידה" את ה-DNA לאנזים וגורמת ליצור מגעים רבים עם עמוד השדרה של ה DNA (השרשראות של הסוכרים).
תפקיד האנזים
אנזים BamH1 מזהה הרצף הדו גדילי 3 -GGATCC-5 ונקשר איליו ומבקע הרצפים האלה אחרי הנוקלאוטיד 5-גאונין בכל גדיל ( G|GATCC) ,ע"י פירוק הקשר הפוספו-דיאסתירי בינו לבין הגאוניו שאחריו, חיתוך זה נקרא חיתוך מדורג. כתוצאה מכך ייווצרו קצוות דביקים אורכם 4 נוקלאוטידים שיש להם נטייה להיצמד לחד גדילי בעל רצף משלים.
לעומתו חיתוך חלק לא ייווצרו קצוות דביקים בגלל שהאנזים מבצע את החיתוך במרכז הרצף כך יתקבל שני מקטעים סימטריים. כמו במקרה של האנזים HaeIII שמבקע את הרצף הבא:

מה המטרה של אנזימי הגבלה בחיידקים ואיך הם לא חותכים הDNA שלהם?
בקטיריופאג'ים הם נגיפים שתוקפים חיידקים ומתרבים בתוכם ע"י החדרת החומר התורשתי שלהם לתוך תא החיידק. בעקבות החדרת החומר התורשתי, הבאקטריופאג'ים "משתלטים" על תהליכים מטבוליים בחיידק ע"מ לייצר את החלבונים והחומר התורשתי של הנגיפים החדשים, תוך כדי גרימת מוות לתאי החיידק. אחד ממנגנוני ההגנה של החיידקים הם אנזימי הגבלה, שחותכים את ה DNA של הנגיף באתרים מסוימים (במקרה של BamH1 ב 3 -GGATCC-5) ובכך הורסים את ה DNA הנגיפי ומונעים את שליטתו והתרבותו.
והשאלה הנשאלת האם אין רצפים כאלה בגנום של החיידק וכך האנזים אולי יחתוך ה DNA החיידקי ויגרום נזק לחיידק עצמו? כמובן שיש! אבל לחיידקים מנגנונים משלהם בזכותם מגנים על עצמם מפני אנזימי החיתוך וזה בא לידי ביטוי ע"י הוספת קבוצת מתיל באמצעות אנזים שנקרא מתילאז לנוקלאוטיד ברצף החיתוך שאותו מזהה האנזים, כך האנזים אינו יכול להתקשר לרצף הזה ולבקעו.
יכול להיות שתתווסף קבוצת מתיל לאותו רצף הגבלה בDNA הנגיפי, אז אנזים החיתוך של החיידק לא יוכל לבקע ה DNA הנגיפי. וזה יקנה עמידות לנגיף מפני החיידק.
שימוש באנזימי החיתוך
גילוי אנזימי ההגבלה הוביל למהפכה גדולה בעולם הביולוגיה במיוחד בתחומי ההנדסה הגנטית והביוטכנולוגיה, הקצוות הדביקים הנוצרים לאחר החיתוך שיש בהם נוקלאוטידים חופשיים לא מזווגים (במקרה של BamH1 ארבע נוקלאוטידים) , יכולים להזדווג עם קטע DNA אחר ובכך ייווצר סליל DNA חדש.
גילוי אנזימי ההגבלה הוביל למהפכה גדולה בעולם הביולוגיה במיוחד בתחומי ההנדסה הגנטית והביוטכנולוגיה, הקצוות הדביקים הנוצרים לאחר החיתוך שיש בהם נוקלאוטידים חופשיים לא מזווגים (במקרה של BamH1 ארבע נוקלאוטידים) , יכולים להזדווג עם קטע DNA אחר ובכך ייווצר סליל DNA חדש.
ולכן הצליחו החוקרים להשתמש בתכונה זאת של האנזים בהנדסה גנטית ע"מ לחבר שני מקטעי DNA שמקורם אפילו מאורגניזמים שונים כמו חיתוך פלמסמיד שמקורו מחיידק ע"מ להחדיר לו גן הורמון האינסולין שמקורו באדם כדי שהחיידק ייצר את ההורמון האנושי. תהליך החדרת מקטע DNA לפלסמיד נקרא שיבוט ומודגם כאן
!הידעתם
פרס נובל לפיזיולוגיה ורפואה לשנת 1978הוענק לורנר ארבר, דניאל נתנס והמילטון או. סמית' על עבודתם על גילוי ואפיון אנזימי הגבלה השימושיים בגנטיקה מולקולרית, הגילוי של אנזימי חיתוך מוביל לפיתוח טכנולוגיית DNA רקומביננטי שיש לה יישומים רבים, למשל, מאפשר ייצור חלבונים בכמויות גדולות מאוד כמו האינסולין האנושי המשמש אנשים עם סוכרת.
שימור האבולוציוני של האנזים
אנזים BamHI שמקורו בחיידקי Bacillus amyloliquefaciens הינו אנזים הגבלה כמו אנזימי הגבלה אחרים שנמצאים במיני חיידקים רבים שנמצאים בטבע חלק מהם מוצג בטבלה 2.
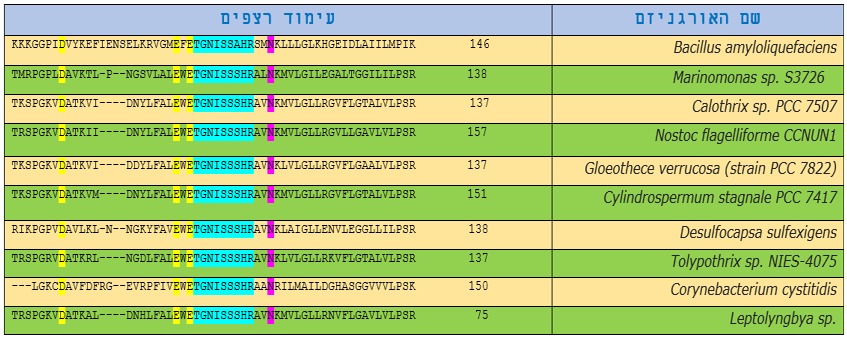
טבלה 2: השוואת עימוד אנזים החיתוך BamhI באורגניזמים שונים.
ברצפים של אותם אנזימים ניתן לזהות אזורים דומים, אשר ייתכן כי הם תוצאה של קשרים פונקציונליים, מבניים או אבולוציוניים. אפשר לראות מתוצאות עימוד האנזים BamHI עם אנזימי הגבלה מחיידקים אחרים כי חומצות האמינו אספרטט D בעמדה 94, חומצה אמינית גלוטמין E בעמדה 111 וחומצה אמינית גלוטמין E בעמדה 113 (מסומנות בצהוב) באנזים BamHI זהות ברצפים של כל האנזימים שבטבלה שכן כולן מהוות את האתרים הפעילים של אנזימים אלו ועל כן הן שמורות בכל החיידקים הנ"ל והן בעלי חשיבות לפעילות החיתוך של אותם אנזימים.
בהתבוננות ברצפי האנזימים השונים בטבלה 2 ניתן לראות שישנם אזורים של רצפים זהים בכל האנזימים כמו האזור TGNISSAHR שמסומן בצבע טורקיז וגם החומצה האמינית אספרגין N בעמדה 125. דבר זה יכול להעיד על חשיבות מבנית לאזורים אלה ועל כן הן שמורות אצל חיידקים אלו.
ההנחה היא שמינים קרובים חולקים גם מטען תורשתי דומה ובתהליך האבולוציה מתרחשת התפצלות כששני צאצאים של חיידקים מתחילים עם מטען גנטי זהה, ולאחר דורות של חלוקה צובר כל מין מוטציות ושינויים במטען הגנטי שגורם לשונות במורפולוגיה ובפונקציונליות הקיימות בין המינים. ועל כן אפשר להניח כי הדמיון בין האזורים השמורים והימצאות חומצות אמינו בעמדות דומות באותם אנזימים הוא עדות לקרבה אבולוציונית בין מיני החיידקים שמקורם מאותו חיידק קדמון.
בהשוואה רצף הDNA של האנזים Bamh1 מהאורגניזם Bacillus amyloliquefaciens עם אנזימים מאורגניזמים רחוקים מצאנו שיש אתרים שמורים חשובים לפעילות האנזים לחיתוך מקטע ה DNA, בחומצות האמינו 94,111,113 חשובות לפעילות האנזים משום שהם מהווים אתר פעיל לאנזים.
לעמדה 112 שנמצאת בין שתי עמדות של האתר הפעיל וקושרת יון מגנזיום. עמדה זו שמורה בכל האורגניזמים, חוץ מהאורגניזם Bacillus amyloliquefaciens .
77,94 אתרים חשובים וקושרות מגנזיום, ולהם חשיבות בפעילות האנזים ובגלל כך הן שמורות.
Relevance
Structural highlights
This is a sample scene created with SAT to by Group, and another to make of the protein. You can make your own scenes on SAT starting from scratch or loading and editing one of these sample scenes.




