User:María Sánchez Morán/TFGParte3
From Proteopedia
| Line 10: | Line 10: | ||
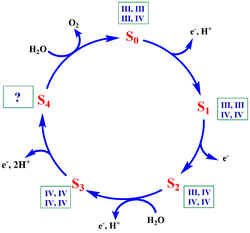
Se ha demostrado que para que se dé la formación de oxígeno molecular en el PSII, éste debe ser sometido a cuatro impulsos luminosos de luz. Este proceso se ha interpretado como un ciclo catalítico (Fig. 3) que consiste en cinco estados principales (de S<sub>0</sub> a S<sub>4</sub>) en los que se van acumulando, con cada impulso luminoso, equivalentes de oxidación de aproximadamente el mismo potencial, que se almacenan en los iones Mn del centro catalítico. [17] | Se ha demostrado que para que se dé la formación de oxígeno molecular en el PSII, éste debe ser sometido a cuatro impulsos luminosos de luz. Este proceso se ha interpretado como un ciclo catalítico (Fig. 3) que consiste en cinco estados principales (de S<sub>0</sub> a S<sub>4</sub>) en los que se van acumulando, con cada impulso luminoso, equivalentes de oxidación de aproximadamente el mismo potencial, que se almacenan en los iones Mn del centro catalítico. [17] | ||
| - | En el estado | + | En el estado S<sub>3</sub>, justo antes de la última captación de fotones, el clúster tiene una configuración en la que los cuatro iones son Mn (IV). El estado S<sub>4</sub> acumula los cuatro equivalentes de oxidación necesarios para la oxidación de dos moléculas de agua a O<sub>2</sub>, tras la cual vuelve al estado S<sub>0</sub>. [16] |
| - | El mecanismo de formación del enlace O-O de la molécula de | + | El mecanismo de formación del enlace O-O de la molécula de O<sub>2</sub> aún no se conoce al detalle debido a la complejidad del entorno proteico, a los cambios estructurales que se producen en el OEC durante la reacción y a la gran velocidad a la que ocurre. [17,18] No obstante, diversos grupos de investigación, basándose en los datos anteriormente mencionados, han estudiado el ciclo con distintas metodologías y han presentado modelos por los que podrían producirse cada una de las etapas, los cuales se presentan a continuación. |
<div id="punto52"></div> | <div id="punto52"></div> | ||
| Line 18: | Line 18: | ||
<StructureSection load='3rec' size='350' side='right' caption='Estructuras propuestas por el grupo de Barber,' scene=''><scene name='90/902774/Abarber_msm/6'></scene> | <StructureSection load='3rec' size='350' side='right' caption='Estructuras propuestas por el grupo de Barber,' scene=''><scene name='90/902774/Abarber_msm/6'></scene> | ||
| - | Para desarrollar esta propuesta, el grupo de Barber se ha basado en las similitudes estructurales | + | Para desarrollar esta propuesta, el grupo de Barber se ha basado en las similitudes estructurales existentes entre el OEC y la enzima carbono monóxido deshidrogenasa que contiene hierro y níquel (Fe-Ni CODH). Esta enzima consiste en un cubano Fe<sub>3</sub>NiS<sub>4</sub> unido a un cuarto Fe vía puente de sulfuro, formando el clúster Fe<sub>4</sub>NiS<sub>5</sub>, que tiene un mecanismo conocido basado en un ataque nucleófilo catalizado por una base. [17] |
| + | |||
| + | En el caso del OEC, se propone la formación del enlace O-O como consecuencia de un ataque nucleófilo de un grupo hidroxilo, que se encuentra ligado al átomo de calcio, a un átomo de oxígeno con carácter electrófilo, unido a un manganeso en alto estado de oxidación. [17, 18] A continuación se presentan las características más importantes de este <scene name='90/902774/Abarber_msm/6'>mecanismo</scene>. | ||
*Este mecanismo depende de que Mn4 alcance un alto estado de oxidación en S<sub>4</sub> y, de esta forma, que el oxígeno unido a él sea deficiente electrónicamente. | *Este mecanismo depende de que Mn4 alcance un alto estado de oxidación en S<sub>4</sub> y, de esta forma, que el oxígeno unido a él sea deficiente electrónicamente. | ||
| Line 30: | Line 32: | ||
*De S<sub>1</sub> a S<sub>2</sub> se produce la oxidación de Mn3(III) a Mn3(IV). | *De S<sub>1</sub> a S<sub>2</sub> se produce la oxidación de Mn3(III) a Mn3(IV). | ||
| - | *En el paso de | + | *En el paso de S<sub>2</sub> a S<sub>3</sub> se produce desprotonación de una molécula de agua sustrato y la oxidación de Mn4(III) a Mn4(IV), alcanzando en S3 una configuración Mn (IV, IV, IV, IV). |
| - | *De S<sub>3</sub> a S<sub>4</sub> debe producirse una nueva oxidación de Mn4(IV) a Mn4(V) y una segunda desprotonación de la molécula de agua unida a Mn4. Esto provocaría que en el estado S4 aparezca un grupo | + | *De S<sub>3</sub> a S<sub>4</sub> debe producirse una nueva oxidación de Mn4(IV) a Mn4(V) y una segunda desprotonación de la molécula de agua unida a Mn4. Esto provocaría que en el estado S4 aparezca un grupo Mn<sup>V</sup>≡O, donde el átomo de oxígeno es deficiente electrónicamente y, por tanto, tiene carácter electrófilo. |
| - | *En la transición de S<sub>4</sub> a S<sub>0</sub>, el hidróxido unido al calcio ataca al oxígeno del grupo | + | *En la transición de S<sub>4</sub> a S<sub>0</sub>, el hidróxido unido al calcio ataca al oxígeno del grupo Mn<sup>V</sup>≡O para formar el enlace O-O. Finalmente, una última desprotonación y la incorporación de dos nuevas moléculas sustrato de agua permiten la liberación de O<sub>2</sub> y la reestructuración del estado S<sub>0</sub>. |
En esta propuesta se sugiere la presencia de Mn(V) en el estado S<sub>4</sub>, que no ha sido identificado experimentalmente en el OEC, aunque cabría la posibilidad de que se deba al corto periodo de vida del S<sub>4</sub>. [17] En contra tiene también los cálculos teóricos realizados posteriormente, que han demostrado la inviabilidad de este mecanismo por las altas barreras energéticas que presenta. [18,19] | En esta propuesta se sugiere la presencia de Mn(V) en el estado S<sub>4</sub>, que no ha sido identificado experimentalmente en el OEC, aunque cabría la posibilidad de que se deba al corto periodo de vida del S<sub>4</sub>. [17] En contra tiene también los cálculos teóricos realizados posteriormente, que han demostrado la inviabilidad de este mecanismo por las altas barreras energéticas que presenta. [18,19] | ||
Revision as of 13:00, 7 February 2022
| |||||||||||