מידע כללי על החלבון
אקטין הוא חלבון המצוי בכל התאים האוקריוטיים. זהו המונומר של שני סוגי סיבים: מיקרופילמנטים שהם חלק משלד התא וסיבים דקים שהם חלק מהשרירים. שלוש איזופורמות (צורות) של אקטין מזוהות: α)Aa) או (G-actin) המצוי ברקמת השריר, אקטין β)Ab) ו-γ)Ag) הם מרכיבים של שלד התא. F-actin קושר Aa ל-ATP.
לפרטים נוספים ראה: *F-actin[[1]]
לחץ כאן כדי לראות את ההבדל בין 2 קונפורמציות של אקטין Ag בקר (ערכי PDB https://proteopedia.org/wiki/index.php/1hlu 1hlu
ו-2btf https://proteopedia.org/wiki/index.php/2btf
אקטין משתתף בהתכווצות השרירים, תנועתיות התא, חלוקת תאים וציטוקינזיס. אקטין הקשור למיוזין אחראי לרוב תנועות התאים.
היסטוריה
האקטין נצפה לראשונה במיקרוסקופ ב-1887 על ידי ו"ד הליבורטון, שבודד מתא שריר חלבון שגרם לקרישת תמצית מיוזין. למרות זאת, הליבורטון לא הצליח לאפיין יותר את החלבון שראה וגילוי האקטין יוחס לברונו פ' שטאוב, ביוכימאי צעיר שעבד במעבדתו של אלברט סנט-דיאורד במכון לכימיה רפואית באוניברסיטת סגד שבהונגריה. ב-1942 פיתח שטאוב טכניקה חדשנית לבידוד חלבון מהשריר שאפשרה לו לבודד כמויות גדולות יחסית של אקטין טהור, בשיטה הדומה לזו שמשתמשים בה כיום לבידוד האקטין.
פעילות האנזים על דופן החיידק
הליזוזים פועל על דופן התא של החיידקים על ידי פירוק השרשרות הסוכריותפוליסכרידים שהן המרכיב העיקרי שלו, באמצעות הידרוליזה. ההידרוליזה גורמת לניתוק של הקשרים המחברים בין היחידות הבסיסיות המרכיבות את השרשרות הסוכריות בעזרת מולקולת מים. כך נהרס דופן התא של החיידק. בשל פעילותו הליזוזים שייך למשפחת הגליקוזידאות, אנזימים המפרקים קשרים בין סוכרים בעזרת מים. האנזים מסוגל לפרק גם קשר גליקוזידי הקיים בכיטין שבונה את דופן הפטריות, אך ביעילות פחותה[1].
דופן התא חיוניות להישרדותו של החיידק. רוב תאי החיידקיים מוקפים בדופן תא שמקיפה את הקרום. הדופן מהווה מבנה קשיח התורם לתמיכה בחיידק, להגנתו ולשמירה על צורתו. הדופן מאפשרת לחיידק להתקיים בסביבה היפוטונית. בסביבה זו ריכוז המומסים קטן יותר מאשר בתוך החיידק לכן מים עוברים באוסמוזה מן הסביבה החיצונית לתוך התא על פי מפל ריכוזים ועלולים לגרום לפגיעה בתא. תפקידה של הדופן, אם כן, לעצור את כניסת המים ולמנוע התרחבות והתפוצצות של קרום התא.
הדופן של תא החיידק מורכבת מחומר הנקרא פפטידוגליקן (סוג של פוליסכריד). הפפטידוגליקן מורכב משרשרות של שני אמינו־סוכרים המופיעים לחלופין: אצטיל גלוקוזאמין-NAG ואצטיל חומצה מוראמית-NAM. כל אצטיל חומצה מוראמית קשור לשרשרת קצרה של 4-5 חומצות אמינו. הפפטידוגליקן הוא למעשה, פולימר המורכב מיחידות מונומר שחוזרות על עצמן. כל מונומר מורכב: NAG - NAM הקשורים זה לזה בקשר גליקוזידי. (ראה איור 1)
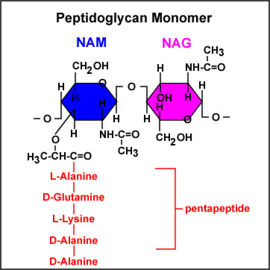
איור 1 - מונומר פפטידוגליקן
פולימר הפפטידוגליקן מתאפיין בכוח מכני גבוה. יחידות הסוכר החוזרות, קשורות זו בזו באופן רציף בצורת רשת של שרשראות ארוכות הקשורות ביניהם באמצעות שרשרות רוחבית קצרות של החומצות האמיניות.(ראה איור 2)

איור 2 - פולימר פפטידוגליקן
אנזים הליזוזים מפרק את דופן החיידקים על ידי פירוק הקשרים הגליקוזידים בין שתי היחידות NAG ו- NAM הקיימות בדופן החיידקים. שתי היחידות מתחברות לאתר הפעיל של הליזוזים, ובו מתבצעת פעולת ההידרוליזה לצורך פירוק הקשר שביניהן (כפי שמופיע באיורים 3-4). פירוק קשרים אלו גורם להרס של דופן החיידק ולאחר כניסת המים מהסביבה החיצונית, קרום החיידק נמתח ומתפוצץ.
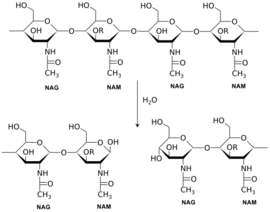
איור 3- הידרוליזה של מונומר הפפטידוגליקן
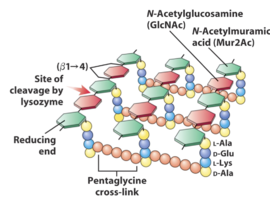
איור 4- מיקום ההידרוליזה בפולימר הפפטידוגליקן
מבנה הליזוזים ותפקידו
אנזים הליזוזים ממקור ביצי העופות נקרא ליזוזים C (זהו האנזים המוצג בערך). אנזים זה הוא אנזים קטן יחסית ומורכב משרשרת אחת , אשר מונה 129 . הליזוזים, כמו כל חלבון, בנוי מקצות . ניתן להבחין בקצוות אלו בעזרת השינויים בצבעים לאורך החלבון. מצבע אדום בקצה C טרמינלי ,דרך צבעי הקשת ועד צבע כחול בקצה ה-N טרמינלי. המבנה של הליזוזים מורכב מחמישה אזורים של ( בוורוד) וחמישה אזורים המרכיבים את (בכחול). שאר השרשרת כוללת פניות וסלילים אקראיים הנראים באפור. המבנים השניוניים האלו תורמים למבנה המרחבי של האנזים כולו. מבנה מרחבי זה מאפשר את הקישור לסובסטרט.
אופיים של שיירי החומצות האמינו בחלבון קובע את רמת הידרופוביות או ההידרופיליות של אזורים שונים בליזוזים. קיפולו של החלבון מושפע ממיקומם של אזורים אלו וקובע את המבנה השלישוני. האזורים ההידרופוביים מופיעים באפור ואילו האזורים ההידרופיליים בסגול. ניתן להבחין בכך שאזורים עם שיירים הידרופוביים נוטים להיות ממוקמים בתוך ליבת המולקולה ואילו אזורים עם שיירים הידרופיליים פונים בעיקר לצד החיצוני של המולקולה, השוהה בסביבה מימית הידרופילית.
הינם קשרים חיוניים לייצובו של כל חלבון. במודל המוצג ניתן להבחין בקשרים אלו, המודגשים בצבע שחור, ותורמים לייצוב המבנה המרחבי (התלת ממדי) של אנזים הליזוזים. קשרים נוספים שניתן לזהות בחלבון הליזוזים הם קשרים דיסולפידים (קשרי גופרית) בין כל שתי חומצות אמיניות ציסטאין. בליזוזים קיימים ארבעה המודגשים בצבע צהוב (העיגולים השחורים מייצגים את אטום הגופרית בציסטאין). גם קשרים אלו נועדו לייצוב במבנה המרחבי של המולקולה וממוקמים בין: Cys 6 ל- Cys 127, בין Cys 30 ל- Cys 115, בין Cys 64 ל- Cys 80 ובין Cys 76 ל-Cys 94. חשיבותם של קשרים אלו למבנה המרחבי ולתפקוד המולקולה באה לידי ביטוי בשימור הקשרים בכל מולקולות הליזוזים בקבוצות אורגניזמים שונות.
שימור אזוריים במולקולה, לאורך האבולוציה מעיד, כאמור, על חשיבותם למבנה המרחבי ולפעילות אנזים הליזוזים. אזורים אלו כוללים בין היתר, את החומצות האמיניות המעורבות ביצירת הקשרים הדיסולפידים וכן את החומצות האמיניות אשר ממוקמות באתר הפעיל (ראה בהמשך) של הליזוזים. ניתן להבחין באזורים השמורים יותר לעומת השמורים פחות על פי סקלת צבעים הנעה מצבע התכלת לצבע הסגול.
האתר הפעיל ומכניזם הפעולה של הליזוזים
הידרוליזה של הקשר בין NAM ל-NAG מתרחשת באתר הפעיל של הליזוזים, שכולל את החומצה הגלוטמית בעמדה 35 (Glu 35) ואת החומצה האספרטית בעמדה 52 (Asp 52). מיקומים אלו שמורים מאוד בליזוזים של אורגניזמים שונים. Glu 35 תורמת פרוטון לקשר הגליקוזידי, כך נחתך הקשר C-O בסובסטרט ואילו Asp 52 משתתפת בהתקפה נוקלאופילית, בעזרת מולקולת מים, לצורך ניתוק האנזים וקבלת הסובסטרט.[2] (המנגנון מודגם באיור 5)
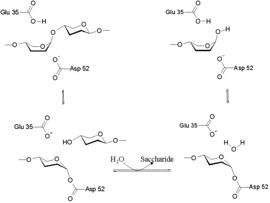
איור 5 - מכניזם הפעולה של ליזוזים
של הליזוזים נראה כמרווח בין Glu 35 (מודגשת ) ל- Asp 52 (מודגשת ). בחלל שנוצר מתמקם הסובסטרט - השרשרת הפוליסכרידית. למעשה, מולקולת הסובסטרט מונה 6 פחמניים. כלומר, מולקולת פוליסכריד בעל 6 טבעות סוכריות שמסודרות בצורת NAM-NAG. החיתוך נעשה בין הסוכר הרביעי לחמישי. נראה ליזוזים מחלבון ביצת תרנגול, ביחד עם הסובסטרט שלו – שרשרת 6 פחמנית. סוכרי השרשרת מסומנים באותיות A-F ומיוצגים על ידי מקלות וכדורים. (חשוב לציין שמודל השרשת ה-6 פחמנית כולל רק יחידות NAG ונבנה באופן מלאכותי .)
העיכוב של פעולת הליזוזים יכול להיעשות על ידי מולקולת "מעכב" שבנויה משרשרת סוכרית קטנה יותר בעלת 3 סוכרי NAG. מולקולת מסוגלת להיקשר לאתר הפעיל וליצור קומפלקס של מעכב-אנזים. המעכב, שמיוצג במודל של מקלות וכדורים, בולט מתוך האתר הפעיל של הליזוזים ומהווה מעכב תחרותי לסובסטרט. מולקולת המעכב, קטנה יותר מהסובסטרט ומתחרה איתו על האתר הפעיל. למרות שמולקולת המעכב נקשרת לאתר הפעיל, לא מתאפשר הזירוז של פירוקו. הסיבה נעוצה בכך שהמעכב בנוי מאתרים A-C, אך לא מכיל אתרים E ו-D שבהם נעשה החיתוך ההידרוליטי על ידי Glu 35 ו- Asp 52. ניתן לעבור בין מודל למודל לצורך הבנת מיקומם של הסובסטרט והמעכב באתר הפעיל של הליזוזים.
דף עבודה לתלמיד
דף עבודה לתלמיד
מקורות מידע
- ↑ Skujiņś J, Puķite A, McLaren AD (December 1973). "Adsorption and reactions of chitinase and lysozyme on chitin". Molecular and Cellular Biochemistry. 2 (2): 221–8. doi:10.1007/BF01795475. PMID 4359167
- ↑ Grisham CM, Garrett RH (2007). "Chapter 14: Mechanism of enzyme action". Biochemistry. Australia: Thomson Brooks/Cole. pp. 467–9. ISBN 0-495-11912-1.






