Actin Protein (Hebrew)
From Proteopedia
| Line 28: | Line 28: | ||
</p> | </p> | ||
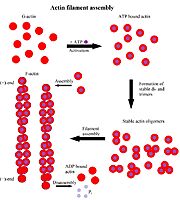
| - | [[Image:G and F actin.jpg|thumb| | + | [[Image:G and F actin.jpg|thumb|right|אופן יצירת F-actin על ידי חיבור של ATP ל-G-actin.]] |
<ref name="LoC">[https://query.libretexts.org/%D7%A2%D7%91%D7%A8%D7%99%D7%AA/%D7%91%D7%99%D7%95%D7%9B%D7%99%D7%9E%D7%99%D7%94_%D7%97%D7%99%D7%A0%D7%9D_%D7%9C%D7%9B%D7%95%D7%9C%D7%9D_(%D7%90%D7%94%D7%A8%D7%9F%2C_%D7%A8%D7%92'%D7%92%D7%95%D7%A4%D7%9C_%D7%95%D7%98%D7%90%D7%9F)/02%3A_%D7%9E%D7%91%D7%A0%D7%94_%D7%95%D7%AA%D7%A4%D7%A7%D7%95%D7%93/2.05%3A_%D7%9E%D7%91%D7%A0%D7%94_%D7%95%D7%AA%D7%A4%D7%A7%D7%95%D7%93-_%D7%A4%D7%95%D7%A0%D7%A7%D7%A6%D7%99%D7%99%D7%AA_%D7%97%D7%9C%D7%91%D7%95%D7%9F_II מבנה ותפקוד- פונקציית חלבון II]</ref> | <ref name="LoC">[https://query.libretexts.org/%D7%A2%D7%91%D7%A8%D7%99%D7%AA/%D7%91%D7%99%D7%95%D7%9B%D7%99%D7%9E%D7%99%D7%94_%D7%97%D7%99%D7%A0%D7%9D_%D7%9C%D7%9B%D7%95%D7%9C%D7%9D_(%D7%90%D7%94%D7%A8%D7%9F%2C_%D7%A8%D7%92'%D7%92%D7%95%D7%A4%D7%9C_%D7%95%D7%98%D7%90%D7%9F)/02%3A_%D7%9E%D7%91%D7%A0%D7%94_%D7%95%D7%AA%D7%A4%D7%A7%D7%95%D7%93/2.05%3A_%D7%9E%D7%91%D7%A0%D7%94_%D7%95%D7%AA%D7%A4%D7%A7%D7%95%D7%93-_%D7%A4%D7%95%D7%A0%D7%A7%D7%A6%D7%99%D7%99%D7%AA_%D7%97%D7%9C%D7%91%D7%95%D7%9F_II מבנה ותפקוד- פונקציית חלבון II]</ref> | ||
Revision as of 10:53, 5 March 2024
Contents |
חלבון אקטין
|
מידע כללי על החלבון
חלבון האקטין, הינו חלבון שמור אבולוציונית (כלומר רצף החלבון דומה מאוד ביצורים שונים). הוא חלבון המעורב בסוגים שונים של תנועתיות תאים ומתבטא בפריסה רחבה בכל התאים האוקריוטיים. אקטין הוא המונומר של שני סוגי סיבים: סיבים שהם חלק משלד התא וסיבים דקים שהם חלק מהשרירים.
אקטין משתתף בהתכווצות השרירים, תנועתיות התא, חלוקת תאים וציטוקינזיס. אקטין הקשור למיוזין אחראי לרוב תנועות התאים. אקטין הוא אחד החלבונים הנפוצים ביותר בתאים איקריוטיים. ריכוז האקטין מתוך סך החלבונים בתאים שריריים משתנה בהתאם לסוג השריר ותפקודו בגוף, כמו גם גורמים נוספים - למשל גיל, מגדר, רמת פעילות פיזית ומצב תזונה. בתאים שריריים ריכוז האקטין יהיה בערך 10%, בעוד בתאים לא שריריים הוא יהיה בין 1-5%.
אקטין הוא אחד החלבונים שהשתמרו ביותר מבחינה אבולוציונית. לדוגמה, ההבדל ברצף החלבון בין אצה לאדם הוא לא יותר מ-5%.
במובן הגנטי, שימור ביולוגי מתקיים כאשר שימושים מסויימים של גנים ממשיכים להיות מועברים מדור לדור, וקורים בתדירות גבוהה במשך הזמן. כאשר משווים בין הרצפים החלבוניים של שני מינים - למשל, אצה ואדם, ניתן לזהות תהליכי אבולוציה ושימור ביולוגי שונים שהביאו להבדלים במבנה החלבונים. דוגמה לכך היא ההבדלים בסדר חומצות האמינו או בפונקציות של החלבונים, שעשויים להשפיע על תכונות פיזיולוגיות וביוכימיות שונות בין המינים. כמו כן, ההבדלים ברצף החלבון עשויים להשפיע על יכולות ותכונות תאיות שונות בין המינים, כמו גם על תהליכי פיתוח ותפקוד של כלל האורגניזם.
לסיבי האקטין מספר תפקידי מפתח בתא:
* תמיכה מכנית בקרום התא.
* קביעת צורת התא.
* תנועת התא.
* השתתפות בסוגים מסוימים של צמתי תאים (מרווחים בין תאים שכנים שמאפשרים מעבר של יונים, מים וחומרים אחרים בין התאים).
* מתן אפשרות להעברת ציטופלזמה מתא לתא.
* כיווץ התא בזמן חלוקת התא - ציטוקינזה (תהליך חלוקת התא מתבצע על ידי סיבים העשויים אקטין ומיוזין שיוצרים טבעות הממוקמות סביב קו האמצע של התא וצמודות אל ממברנת התא. במהלך תהליך החלוקה טבעות הסיבים מתכווצות, ומושכות פנימה את קו האמצע של התא (בדומה למשיכת חוט לשם סגירת שקית). טבעות הסיבים הולכות ומתכווצות עד שתא האם נצבט כולו ומתחלק, ובכך נוצרים שני תאי בת עצמאיים וזהים לחלוטין).
* בתאי השריריים, השתתפות בכיווץ התא יחד עם מולקולות מיוזין.
שלושה איזופורמים (צורות) של אקטין מזוהות אצל חולייתנים: α)Aa) (נקרא גם G-actin - אקטין "גלובולרי") - הוא יחידה בודדת של החלבון המצוי ברקמת השריר ומהווה מרכיב מרכזי במנגנון ההתכווצות. הפולימר שנוצר מחיבור של מספר יחידות G-אקטין נקרא "F-אקטין" והוא Aa שקשור ל-ATP. צורות נוספות של אקטין הן β)Ab) ו-γ)Ag), שהם מרכיבים של שלד התא ומתווכים של תנועתיות פנימית של תאים.
לפרטים נוספים ראה:
*2 קונפורמציות של אקטין Ag: 1hlu 2btf
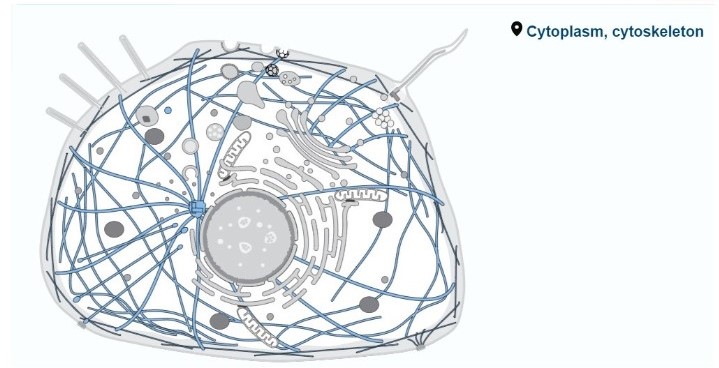
:מיקום סיבי האקטין בתוך התא
שלד התא הוא מבנה חוטי תלת מימדי דינמי בציטופלזמה. תפקידיו כוללים שמירה על צורת התא, תנועת תאים (באאוקריוטים), תנועת התא וארגון אברונים או מבנים דמויי אברונים בתוך התא. שלד התא כולל סיבים ומולקולות ארוכות מסוגים שונים, שבנויות בין היתר על אקטין. סיבים אלו מסומנים בתמונה כחוטים ארוכים כחולים.
היסטוריה
האקטין נצפה לראשונה במיקרוסקופ ב-1887 על ידי ו"ד הליבורטון, שבודד מתא שריר חלבון שגרם לקרישת תמצית מיוזין. למרות זאת, הליבורטון לא הצליח לאפיין יותר את החלבון שראה וגילוי האקטין יוחס לברונו פ' שטאוב, ביוכימאי צעיר שעבד במעבדתו של אלברט סנט-דיאורד במכון לכימיה רפואית באוניברסיטת סגד שבהונגריה. ב-1942 פיתח שטאוב טכניקה חדשנית לבידוד חלבון מהשריר שאפשרה לו לבודד כמויות גדולות יחסית של אקטין טהור, בשיטה הדומה לזו שמשתמשים בה כיום לבידוד האקטין.
מבנה החלבון
|
חלבון האקטין שמוצג (מתוך הארנבון המצוי - Oryctolagus cuniculus).
החלבון מורכב משרשרת אחת, אשר מונה 375 חומצות אמינו. לחלבון קצוות C ו N, החלבון נצבע מצבע אדום בקצה C טרמינלי בצבעי הקשת עד עד צבע כחול בקצה ה-N טרמינלי. זהו המבנה הראשוני של החלבון. המבנה הראשוני מתייחס לסידור הקווולנטי הבסיסי של חלבון האקטין. ברמה זו, החומצות האמיניות מסתדרות לפי הרצפים שלהן, והן חוברות ביחד על ידי קשרים פפטידיים.
מתייחס לקשרים משניים הנוצרים בין חומצות האמינו השונות, המאפשרים מבנים סלילי אלפא, מישורי בטא ופניות. חלבון זה מורכב מעשרים וחמישה אזורים של אלפא (צבועים בורוד), עשרים וחמישה אזורים המרכיבים את מישורי בטא (בצהוב) וארבעה אזורים של פניות (צבועים בכחול).
המבנה השניוני משפיע על המבנה השלישוני של החלבון - כלומר, הקשרים בין המבנים השניוניים ויצירת המבנה המרחבי הכללי של המולקולה, שמאפשר את הקישור לסובסטרטים השונים.
:הפעילות הקטליטית של החלבון
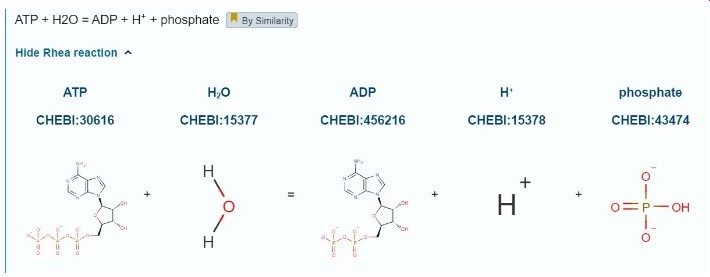
<p dir='rtl'> האקטין קושר ATP, הקומפלקס של מולקולת האקטין עם מולקולת ATP יוצר פולימר בצורה יעילה ומתפרק בצורה איטית (כלומר - בונה את סיב האקטין בתוך התא) לעומתו, הקומפלקס אקטין-ADP מתפרק בצורה יעילה ויוצר פולימר בצורה איטית (כלומר - עוזר בפירוק סיב האקטין בתא). ניתן לראות את מיקום ה-ADP בחלבון.
קישור לחלבונים ומולקולות אחרות
ראשית, התכווצות השרירים והפעילות של האקטין קשורה גם לחלבון נוסף, מיוזין, שתהליך פעילותו והתכווצות השריר באופן כללי מבוקרים גם על ידי עלייה בריכוז יוני הסידן המסומנים בהדמיה כעיגולים ירוקים.
מולקולת האקטין משפיעה על התנועה בחלבון באמצעות הפעילות הקטליטית שלו - קישור לATP ופירוקו ל-ADP ופוספט. הפעילות הזו מתאפשרת בזכות הקישור שלו גם למולקולת מיוזין.
1. בשלב הראשון, יש מולקולות שחוסמות את אתרי הקשירה של האקטין למיוזין, ואינו מאפשר את התכווצות השריר. כשיוני סידן נקשרים למולקולות האלו, האקטין יכול לנוע לאיזורים שונים וליצור אינטראקציה מרחבית עם מולקולות המיוזין. כך הוא נחשב "מחובר".
2. כש-ATP נקשר למיוזין, הקשר בין המיוזין לאקטין משתחרר, והאקטין נחשב "משוחרר". השרירים מצויים בשלב זה במצב נוקשה.
3. בשלב הבא, מתרחשת הידרוליזה (פירוק) של ה-ATP והתוצרים (ADP ופופסט) נשארים קשורים למולקולה, והאקטין נחשב "דרוך".
4. המגע הקטן ביותר עם סיבי האקטין גורם לשחרור הפוספט, לחיזוק הקשר בין האקטין למיוזין ובכך כיווץ של השריר - כוח של דחיפה ודחיסה במבנה כולו - "הפעלת כוח".
החלבון אקטין נקשר (בעמדה 112-125 ובעמדה 360-372) גם לחלבון העזר אלפא-אקטינין - שבדומה לחלבון נוסף - פימברין, יוצר מערכים מקבילים לאקטין. האלפא-אקטינין יוצר מבנה שמתכווץ, למשל בשריר חלק או אפיתל.
(פימברין - חלבון המשתתף בתהליך החלוקה התאית, במיוחד בתאים המתחלקים במהלך חיי התא הרגילים וגם בתאים סרטניים. התפקיד העיקרי של הפימברין הוא לשלוט ולתזמן את מהירות החלוקה התאית על ידי השפעה על האנזימים המעוררים חלוקת התא. יש לפימברין תפקיד חשוב בתהליכי תיקון תקלות גנטיות ובהגנה מפני נזקים כימיים.)
החלבון אקטין המגובש [3] המוצג כאן, נקשר גם שנקראת RHO - TETRAMETHYLRHODAMINE-5-MALEIMIDE. המולקולה הזו היא גשש פלורסנטי, שנקשר לחלבון ומונע ממנו לעבור פולימריזציה כך שיוכל לעבור גיבוש וכמו כן נותן לו צבע אדום אופייני שמזוהה לאחר הגיבוש.
עוד מידע על חלבונים קושרי אקטין בסרטון הבא
מחלות קשורות
מוטציות ב-a-actin הנמצאות בשרירים מחוספסים בשלד עלולות לגרום למיאופתיה. מוטציות ב-a-actin הנמצאות בשרירים חלקים עלולות לגרום למפרצת של אבי העורקים החזה. מוטציות ב-a-actin הנמצאות בשרירי הלב עלולות לגרום לתפקוד לקוי של הלב.
מוטציה אחת כזו היא "D286G"
[4] - זו מוטציה נקודתית בה חומצה האמינו D במיקום 286 ברצף חומצות האמינו של החלבון A-actin מוחלפת בגליצין (G). ההחלפה הזו משנה את המבנה המרחבי של המולקולה באיזור הקרוב לקצה ה-C של החלבון. קצה זה משמש בתהליכים שונים כגון חיבור לחלבון מיוזין.
כיוון שהקישור למיוזין משפיע על פעילות החלבון כולו, על התכווצות השריר ותנועת התאים - מוטציה בנקודה זו משנה את תהליך ההתקשרות בין האקטין למיוזין, ובכך משפיעה על יכולת השריר להתכווץ ולבצע פעולות מכניות בתאים המכילים אותו.
לכן, אדם עם מוטציה זו עשוי להציג תסמינים ותפקוד לקוי של הלב, כגון עיוותי דופק או בעיות ביצור כוח. יש לציין שהמידע בנוגע להשפעה המדויקת של מוטציה כזו הוא עוד ראשוני ודרוש מחקר נוסף.
קישורים נוספים
מקורות מידע
- ↑ מבנה ותפקוד- פונקציית חלבון II
- ↑ https://www.uniprot.org/uniprotkb/P68135/entry
- ↑ המבנה המגובש של אקטין
- ↑ Molecular Consequences of the Myopathy-Related D286G Mutation on Actin Function
בואו נראה אתכם - וידוא הבנה