Estructura de la IDH1 y sitio activo
La IDH1, con código1T09 en PDB, tiene como ligando la NADP y por lo tanto forma un complejo binario IDH1-NADP.
Existe otra IDH1 con código 1T0L en PDB, que conforma una estructura cuaternaria ya que contiene tres ligandos: ICT, NADP y Ca2+, por lo que el complejo cuaternario será IDH1- ICT-NADP-Ca2+. Su estructura contiene cuatro subunidades: A, B, C y D, cada una con sus tres ligandos.
Sin importar el número de subunidades que presente cada una de las estructuras de IDH1 (1T09 complejo binario y 1T0L complejo cuaternario), las dos estructuras presentan tres dominios:
- Dominio grande (L): residuos 1-103 y 286-414.
- Dominio pequeño (S): residuos 104-136 y 186-285.
- Dominio clasp (C): residuos 137-185.
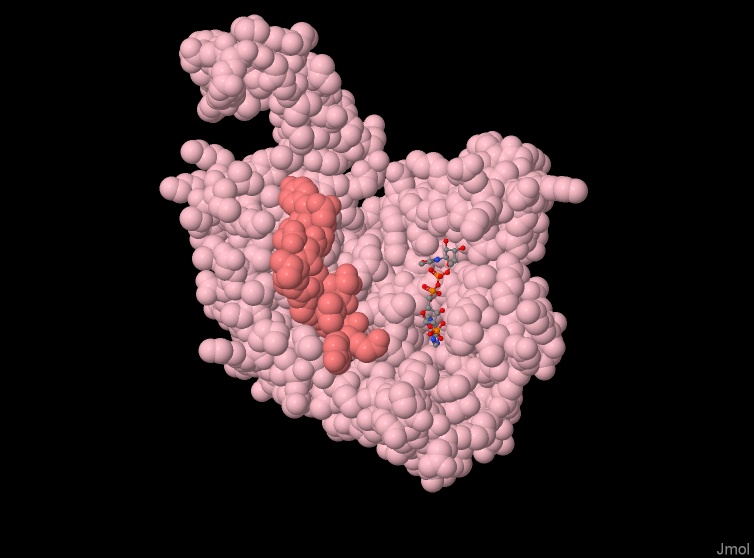
Además, presentan un segmento regulatorio formado por los residuos 271-286 en el sitio activo, a partir de aquí llamado péptido regulador.
Escena 1. Representación de los dominios de la enzima ID09
La conformación de la subunidad A (rojo) en el complejo binario (IDH-NADP) se parece más a la forma abierta. Proponen que la conformación abierta de IDH puede representar a la forma inactiva de la enzima.
La conformación de IDH de la subunidad B (azul) del complejo binario (IDH-NADP) está entre la forma abierta y la cerrada. Proponen que la forma semiabierta de la IDH puede representar una forma intermedia entre la conformación activa y la inactiva.
Escena 0. Conservación evolutiva"
Escena 2. Superposición de las subunidades A y B de IT09
Con esta escena se quiso observar el cambio conformacional de abierta a semiabierta.
Se hizo un alineamiento jFATCAT flexible y dio como resultado un RMSD de 0.95 angstroms, lo cual indicó que había muy pocas diferencias entre una subunidad y la otra.
Lo interesante de esta escena es que permitió ver el cambio conformacional que se hablaba anteriormente de abierta (cadena A) a semiabierta (cadena B).
Escena 3. Superposición de las cadenas A de 1T09 y 1T0L
El objetivo de esta escena fue poder observar el cambio conformacional del péptido regulador cuando entran los ligandos ICT y Ca2+ en el complejo cuaternario.
Se hizo un alineamiento entre las cadenas A de 1T09 y 1T0L jFATCAT flexible, lo cual resultó en un RMSD de 3.34 Angstroms, valor que indica ciertos cambios en las estructuras que observamos en la escena.
La imagen de la izquierda (activa) es la cadena A de la 1T0L (cuaternario) con ICT en blanco y Ca2+ en cyan, A la derecha (inactiva) la cadena A de la 1T09 (binario). NADP amarillo y péptido regulatorio en naranja en ambas imágenes. Los colores de los dominios se mantienen de acuerdo a las anteriores escenas.
Además, el modelo de trabajo de Xiang Xu et al. postula que la IDH puede utilizar el segmento regulatorio y las interacciones de Asp279 (morado) con Ser94 (verde pistacho) para inactivar la enzima, lo cual se comprueba con la escena 3D puesto que se observó que al entrar ICT y Ca2+, la proteína reguladora cambia de conformación al igual que lo hacen Asp279 y Ser94.
La unión competitiva del isocitrato induce el replegamiento de la proteína reguladora y los cambios conformacionales generales y consecuentemente para activar la enzima.
Escena 4. Alineamiento 1T09 con 1T0L, cadenas A
Con el siguiente comando: contact {ICT} full connect se buscaron los contactos del ICT en Jmol, y como se esperaba, aparecieron los 15 contactos que se describe en el paper:
- Thr77, Ser94, Arg100, Arg109, Arg132, Tyr139, y Asp275 en una subunidad
- Lys212, Thr214, y Asp252 en la subunidad adyacente
- 3 moléculas de agua, NADP y Ca2+
Escena 5. Interacción Arg132 con ICT
Mutación en la Arg132 y su relación con el cáncer
Recientemente se ha descubierto que el NADP-IDH citosólico humano está implicado en la tumorigénesis. En particular, las mutaciones IDH1 derivadas de tumores identificadas ocurren principalmente en Arg132, y la mutación R132H es la más prevalente.
Arg132 desempeña múltiples funciones funcionales en la reacción catalítica; en particular, la mutación R132H dificulta los cambios conformacionales desde el estado inicial de unión a las ICT al estado previo a la transición, lo que lleva al deterioro de la actividad IDH.
Las mutaciones en la enzima causan la aparición de una nueva actividad catalítica que provoca la conversión de alfa-cetoglutarato (α-KG) en 2-hidroxiglutarato (2-HG), que desregula un conjunto de dioxigenasas dependientes de α-KG. Específicamente, debido a la estructura similar entre 2-HG y α-KG, 2-HG bloquea competitivamente la unión de α-KG a histonas desmetilasas, como la desmetilasa específica de lisina (KDM), y luego aumenta la metilación de histonas. El 2-HG también inhibe la actividad de diez a once hidroxilasas de translocación, que son importantes para la metilación global del ADN.
Por otro lado, los altos niveles de 2-HG debido a las mutaciones de IDH, estabilizan el factor HIF alfa debido a que disminuyen los niveles de una endostatina de HIF-1α lo cual resulta en la upregulación de los genes dependientes de la endostatina HIF-1α, que incluyen el VEGF factor de crecimiento vascular endotelial.
Escena 6.
Distintas conformaciones pueden representar diferentes estados enzimáticos
Los dos complejos (binario y cuaternario) contienen tres conformaciones diferentes. La conformación general del complejo cuaternario se parece a la cerrada. La zona activa puede adoptar una conformación compacta o cerrada.
En la evidencia, sugieren que las diferencias conformacionales de los segmento regulatorio en los tres conformadores de IDH son probablemente relacionado con las funciones biológicas de la enzima, en lugar de un artefacto, y que las distintas conformaciones de IDH observadas en las dos estructuras complejas probablemente sean biológicamente relevantes y puede representar diferentes estados enzimáticos.
Conclusión
Se ha comprobado la gran utilidad de las representaciones en 3D para biomoléculas complejas en publicaciones científicas. La visualización en 3D permite acercarse a las estructuras para así entender mejor su composición y función, así como las uniones con sus ligandos y sus cambios conformacionales; cosas que en el mundo 2D a menudo se escapan.
Your Heading Here (maybe something like 'Structure')
Anything in this section will appear adjacent to the 3D structure and will be scrollable.

