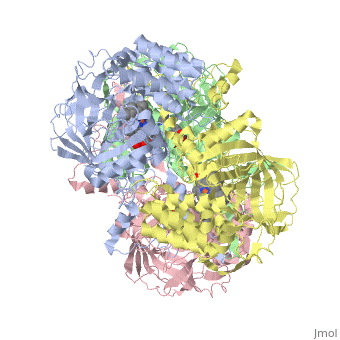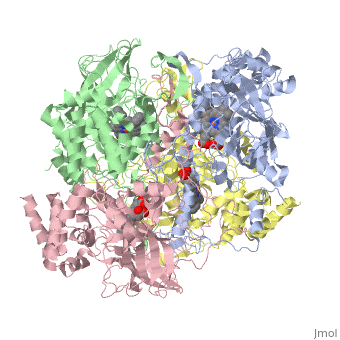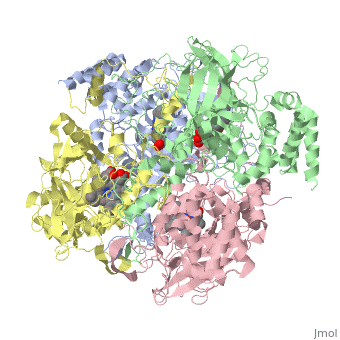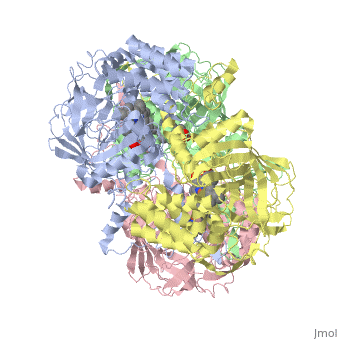Catalase (Hebrew)
From Proteopedia
Contents |
קטלאז
|
קטלאז הוא אנזים המצוי כמעט בכל האורגניזמים הנחשפים לחמצן: בבעלי חיים, בצמחים, בפטריות ובמיקרואורגניזמים רבים. באדם מצוי הקטלאז כמעט בכל תאי הגוף ואיבריו, ובכמות גדולה נמצא בכבד, בכליות ובתאי הדם. תפקידו של אנזים הקטלאז הוא לפרק מי חמצן, H2O2, למים ולחמצן. משקלו המולקולרי של החלבון השלם הוא כ- 60 קילו-דלתון.
חשיבותו של קטלאז
בתהליך ניצול החמצן להפקת אנרגיה, תהליך הקרוי נשימה תאית, נוצרים גם שני תוצרי לוואי רעילים:מי חמצן (H202) ויון סופראוקסיד (O2-). שני חומרים אלו הם מחמצנים חזקים, ונוטים להגיב כמעט עם כל חומר אורגני ולשנות את הרכבו. לפיכך, הם מזיקים לתא ועלולים אף לגרום למותו. היצורים האירוביים הצליחו להתגבר על בעיה זו באמצעות שלושה אנזימים המצויים בתאיהם, אשר מנטרלים את תוצרי הלוואי המזיקים : • סופראוקסיד דיסמוטאז • פרוקסידאז • קטלאז - האנזים הפעיל ביותר בנטרול תוצרי הלוואי המחמצנים , ההופך מי חמצן למים ולחמצן. אנזים הקטלאז מצוי באברון הפראוקסיזום בתאים, ושם הוא מבצע את פעולתו.
מבנה הקטלאז
מבנה אנזים הקטלאז ממקורות שונים נחקר באמצעות קריסטלוגרפיה. מהשוואת מבנה החלבון בין מינים שונים של יצורים עולה דמיון רב. האזורים השמורים במרכז החלבון מעידים על רמת דמיון גבוהה סביב לאתרים הפעילים בחלבון אצל מינים רבים. אנזים הקטלאז הוא הומוטטרמר - חלבון הבנוי מ- 4 שרשראות פוליפפטידיות זהות ( כל אחת צבועה בצבע שונה ) באורך 527 חומצות אמינו כל אחת. רצף חומצות האמינו בכל תת-יחידה של החלבון מהווה את המבנה הראשוני של החלבון. בין חומצות האמינו הסמוכות קיימים קשרים פפטידיים. קשרי מימן הנוצרים בין חומצות אמינו שונות לאורך המבנה הראשוני של החלבון יוצרים מבנה מרחבי המקפל את החלבון לשתי צורות עיקריות של מבנים שניונים: סליל אלפא ומשטח בטא. בין שיירי חומצות האמינו המרוחקים זה מזה על פני הרצף הקוי נוצרים קשרים אשר גורמים להיווצרות המבנה השלישוני של החלבון. האופן בו ארבעת תת-היחידות ארוזות יחדיו קובע את הבמנה הרביעוני של החלבון. כל אחת מ- 4 המונומרים של האנזים מכיל קו-פקטור: קבוצת הם שבמרכזה אטום ברזל. במולקולת הקטלאז, אם כן, יש 4 קבוצות הם ו- 4 אטומי ברזל. קבוצת ההם מחוברת באמצעות קשר בין יון הברזל ושייר סמוך של חומצת האמינו תירוסין ( מספר 358 ברצף ). קבוצת ההם היא טבעת מישורית מורכבת שבמרכזה מצוי יון ברזל אליו נקשרת מולקולת מי החמצן המהווה את הסובסטרט של האנזים. בקטלאז ממינים מסוימים, כגון בקר, מצוי, בנוסף ל- 4 קבוצות ההם, גם 4 קבוצות של NADPH שמשמשים להגנה על האנזים עצמו מפני הפעילות הרעילה של מי חמצן.
הפעילות הביולוגית של קטלאז
פעולתו של האנזים קטלאז (מיוצג בנוסחת התגובה כ- FeCat ) מתבצעת בשני שלבים: (הספרות רומיות שצמודות לסימון הברזל (Fe) מציינות את רמת החמצון של הברזל)
==H2O2 + OFe(IV)Cat-> H2O + Fe(III)Cat + O2
בשלב הראשון של התגובה אטום חמצן מתנתק ממי החמצן ונקשר לאנזים; מי החמצן הופכים למים. בשלב השני אטום חמצן נוסף מתנתק ממולקולה אחרת של מי חמצן, ושני אטומי החמצן חוברים ליצירת מולקולת חמצן. התוצאה הסופית היא שתי מולקולות מים ומולקולת חמצן אחת: בטבע, קטלאז הוא אחד האנזימים בעלי זמן המחזור (turnover number) הגבוהים ביותר: מולקולת קטלאז אחת מסוגלת לפרק מיליוני מולקולות מי חמצן מדי שנייה. ה-pH האופטימלי לקטלאז באדם הוא 7. במינים אחרים משתנה ה-pH האופטימלי ועשוי לנוע בטווח של 4 עד 11, תלוי במין. הטמפרטורה האופטימלית שונה גם היא באורגניזמים השונים. בבני אדם הטמפרטורה האופטימלית היא C370 , שהיא טמפרטורת הגוף בקירוב. לעומת זאת, בחיידקים תרמופילים שמקורו במעיינות חמים (Pyrobaculum calidifontis ) נמצא קטלאז בעל אטום מנגן כקופקטור, במקום קבוצת הם, שהטמפרטורה האופטימלית לפעילותו היא C900!
קטאלז בנוי מארבע לקטלאז אתר פעיל הקושר הם והוא מורכב לקטלאז יש שרשראות ביתא ואלפא