2x0s (Italian)
From Proteopedia
| |||||||||
| 2x0s, resolution 3.00Å () | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Activity: | Pyruvate, phosphate dikinase, with EC number 2.7.9.1 | ||||||||
| |||||||||
| |||||||||
| Resources: | FirstGlance, OCA, PDBsum, RCSB | ||||||||
| Coordinates: | save as pdb, mmCIF, xml | ||||||||
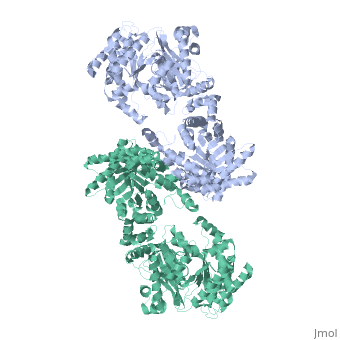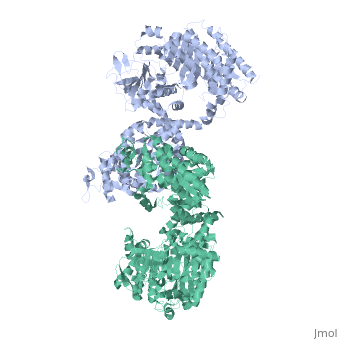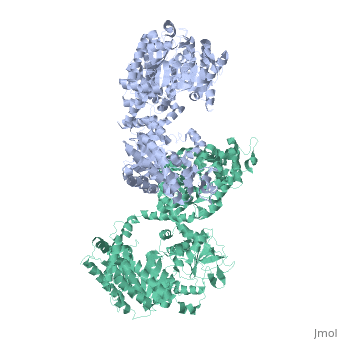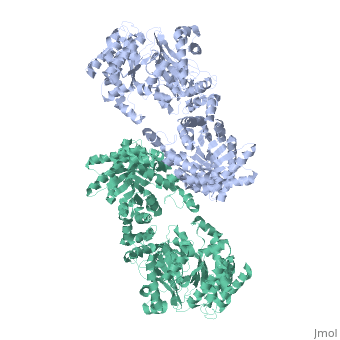
STRUTTURA CRISTALLOGRAFICA A 3.0 A DI RISOLUZIONE DELLA PYRUVATE PHOSPHATE DIKINASE GLICOSOMALE DI TRYPANOSOMA BRUCEI
La struttura cristallografica dell'enzima glicosomale pyruvate phosphate dikinase del parassita protozoario africano Trypanosoma brucei è stata risolta a 3.0 A di risoluzione per sostituzione molecolare. Il modello di ricerca era la struttura a 2.3 A di risoluzione dell'enzima di Clostridium symbiosum. A causa degli orientamenti relativi differenti degli domini e sub-domini nelle due strutture, la sostituzione molecolare non è potuta essere realizzata che posizionando questi elementi, quattro corpi in tutto, sequenzialmente nell'unità asimmetrica del cristallo di gruppo spaziale P2(1)2(1)2 che contiene una sub-unità della pyruvate phosphate dikinase (PPDK). Il modello affinato, comprendendo 898 residui e 188 molecole di solvente per sub-unità, ha un residuo cristallografico Rf =0.245 (fattore R libero Rfree =0.291), e mostra una stereochimica soddisfacente. Otto regioni, comprendendo un totale di 69 residui alla superficia della molecola, sono disordinate in questa forma cristallina. Le sub-unità di PPDK sono aggiustate intorno all'asse cristallografico di ordine 2 come un dimero, analogo a quell'osservato nell'enzima di C. symbiosum. Il paragone delle due strutture è stato effettuato da sovrapposizione dei due modelli. Sebbene il ripiegamento di ogni dominio o sub-dominio siano simili, gli orientamenti relativi di questi elementi costitutivi sono differenti nelle due strutture. L'enzima tripanosomale è "più ricurva" che l'enzima batterica, con la curvatura che aumenta dal centro della molecola, vicino all'asse di ordine 2 molecolare, verso la periferia dove il dominio N-terminale è localizzato. Conformemente a questa curvatura aumentata e delle differenti posizioni relative degli sub-domini, la fessura di legame del nucleotide nel dominio amino-terminale è più larga nella PPDK di T. brucei: il frammento N-terminale del dominio amino-terminale è localizzato a distanza del histidine catalitica 482, competente per la reazione di fosfo-trasferimento, pressappoco a 10 A di distanza. Le nostre osservazioni suggeriscono che le esigenze di movimenti di domini durante la catalisi per l'enzima potrebbero includere l'allargamento della fessura di legame del nucleotide, per permettere l'accesso e la partenza dei ligands AMP o ATP.
The 3.0 A resolution crystal structure of glycosomal pyruvate phosphate dikinase from Trypanosoma brucei., Cosenza LW, Bringaud F, Baltz T, Vellieux FM, J Mol Biol. 2002 May 17;318(5):1417-32. PMID:12083528
From MEDLINE®/PubMed®, a database of the U.S. National Library of Medicine.
Riassunto tradotto da MEDLINE®/PubMed®, una banca dati del U.S. National Library of Medicine.
A proposito di questa struttura
2X0S è una struttura a 1 catena di sequenza di Trypanosoma brucei. Dalle informazioni cristallografiche completi sono disponibili su OCA. Numeri biologici appropriati per questa proteina su B10NUMB3R5
Riferimenti
- Cosenza LW, Bringaud F, Baltz T, Vellieux FM. The 3.0 A resolution crystal structure of glycosomal pyruvate phosphate dikinase from Trypanosoma brucei. J Mol Biol. 2002 May 17;318(5):1417-32. PMID:12083528
- Cosenza LW, Bringaud F, Baltz T, Vellieux FM. Crystallization and preliminary crystallographic investigation of glycosomal pyruvate phosphate dikinase from Trypanosoma brucei. Acta Crystallogr D Biol Crystallogr. 2000 Dec;56(Pt 12):1688-90. PMID:11092947
- Bringaud F, Baltz D, Baltz T. Functional and molecular characterization of a glycosomal PPi-dependent enzyme in trypanosomatids: pyruvate, phosphate dikinase. Proc Natl Acad Sci U S A. 1998 Jul 7;95(14):7963-8. PMID:9653123