Factor VIII (Hebrew)
From Proteopedia
פקטור 8 - עמוד בעריכה
| |||||||||||
קרישת דם
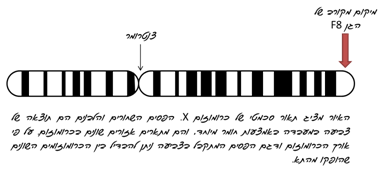
קרישת הדם היא תהליך רב שלבי המתרחש בפלסמה ובו מעורבות טסיות הדם המפעילות את מנגנון הקרישה. במנגנון זה פעילים מספר חלבונים המפעילים זה את זה. שרשרת פעולות זו מתחילה לאחר פציעה של כלי דם (ראו אנימציה המתארת קרישת דם). פקטור VIII הוא קו-פקטור המפעיל את החלבון הבא אחריו בשרשרת הקרישה - פקטור IX.
פגמים בחלבון זה, גורמים למחלת המופיליה מטיפוס A, ולכן פקטור VIII מכונה גם פקטור-אנטי-המופילי.
במהלך התהליך נוצרת במהירות סתימה, המונעת את איבוד הדם מכלי הדם הפגוע. הסתימה מתאפשרת הודות לפקק ראשוני של טסיות הנספחות אל מקום הפציעה, וליצירת סיבי חלבון בלתי מסיס - פיברין, הנוצר מחלבון פלסמה מסיס, שקרוי פיברינוגן. סיבי הפיברין יוצרים מעין רשת שלוכדת את תאי הדם וסוגרת על הפצע בפקק סופי.
טסיות הדם הן שברי תאים הנוצרים מתאי ענק – מגה-קריוציטים, ומספרם גבוה מזה של תאי הדם הלבנים. בתוכם שלפוחיות מלאות בחמרים הנשפכים באזור הפגוע והמפעילים את מנגנון הקרישה. חשיפת אזורים חיצוניים של כלי הדם הפגוע כמו סיבי קולגן, מעודדת את הטסיות להיספח אל מקום הפגיעה.
לעצירת הדם יש שני שלבים:
1. יצירת פקק ראשוני מערכת תאית הכוללת את טסיות הדם, אשר נמצאות בזרם הדם, ואשר יוצרות "פקק" של טסיות (platelet plug) בכלי דם פגועים.
2. יצירת קריש דם : מערכת קרישה המורכבת מחלבונים הנקראים גורמי קרישה, כדוגמת פקטור VIII ופקטור IX, אשר תפקידם להביא ליצירת קריש פיברין.
מבנה
החלבון מורכב : שרשרת ״כבדה״ (בגווני אדום), המונה 754 חומצות אמיניות (ומורכבת מהמתחמים A1, A2, ו- B, שלא מופיעה בחלבון המוצג) ושרשרת ״קלה״ (בגווני כחול) המונה 684 חומצות אמיניות (ומורכבת מהמתחמים A3, C1 ו- C2). שתי השרשראות הללו יוצרות ביחד מולקולה הטרו-דימרית. מולקולה הטרו-דימרית היא מולקולה המורכבת משתי (די) תת-יחידות (מר) שונות (הטרו).
בכדי לייצב את ההטרודימר, יש צורך של יון נחושת (Cu בירוק) ושל יון סידן (Ca בורוד).
שחבור חלופי
כאמור, המידע ליצירת שתי תת-היחידות המרכיבות את פקטור VIII נמצא על גן אחד, המכונה F8. תופעה זו, של יצירת שני תוצרים שונים מאותו הגן מתאפשרת הודות למנגנון שחבור חלופי.
שחבור הוא התהליך בו קטעים מסוימים ממולקולת RNA, המורכבת על-פי DNA), נחתכים החוצה מן המולקולה, והקצות החתוכים מחוברים זה לזה. החתיכות שמוצאות מן המולקולה נקראות "אינטרונים", והחתיכות שנשארות במולקולת ה- RNA (שבסוף תהליך העיבוד הזה נקראת mRNA) נקראות "אקסונים".
שחבור חליפי מתאפשר כאשר יש יותר מאפשרות אחת של שחבור באותה המולקולה. מולקולת ה- RNA שנוצרה על פי הגן F8 מכילה אקסונים רבים, ועל כן יש שתי אפשרויות שונות של חיתוך אינטרונים וחיבור אקסונים. האפשרויות השונות הללו הן היוצרות את שתי תת-היחידות השונות של החלבון.
איך יודעים כמה אקסונים מכיל גן מסוים? לכל הגנים המוכרים לנו כיום (בין אם יודעים את תפקידם ובין אם לאו) ישנה רשומה, המצויה במאגר מידע גדול, ובה מצוי כל המידע על הגן. ברשומה ניתן לראות היכן נמצאים האזורים המקודדים (CDS), היכן נמצאים האקסונים (exon) ועוד מידע רב וחשוב, כמו רצף הנוקלאוטידים או רצף חומצות האמינו, המקודדות על פי רצף הנוקלאוטידים.
הפעלה ותפקוד
פקטור VIII מסונתז בכבד כפרו-חלבון, וזו הצורה בה הוא נע בזרם הדם, כאשר הוא בקומפלקס עם פקטור וון-וילברנד (vWF). הקישור ל- vWF מתבצע רק לאחר שקבוצת סולפט נקשרת בעמדה 1699.
כדי שפקטור VIII יהיה פעיל, הוא צריך לעבור על ידי תרומבין. ביקוע זה מפרק את הקומפלקס עם vWF, ומאפשר תגובה עם פקטור IXa, שהוא חלק מהשרשרת הארוכה של מנגנון הקרישה.
תעתיק אחד מקודד למולקולת גליקופרוטאין גדולה, שנעה בזרם הדם כשהיא קשורה בקשר לא קוולנטי ל- vWF. הגליקופרוטאין הזה עובר מספר ביקועים, המתבצעים באתרים שונים על פני החלבון. התעתיק השני מקודד לחלבון קטן, המכיל אתר קישור לפקטור VIIIc. קישור זה חיוני לפעולת הקרישה.
כאשר פקטור VIII לא קשור ל- vWF הוא חשוף לביקוע פרוטאוליטי, דבר שמסלק אותו מזרם הדם.
מחלות
אנשים עם רמות גבוהות של הפקטור VIII נמצאים בסיכון מוגבר ל פקקת ורידים ותסחיף ריאתי. נשים המבטאות רמות גבוהות של פקטור VIII עלולות לסבול מתדירות גבוהה של הפלות, בעקבות קרישיות יתר המשבשת את זרימת הדם התקינה לעובר.
קריאה נוספת
</StructureSection>