חלבון ה SPIKE חיוני לפעילות הנגיף, ומשמש אותו לחדירה לתאי המטרה שלו במערכת הנשימה. בעזרת חלבון ה SPIKE נקשר הנגיף לתאי המטרה שלו על ידי קישור לרצפטור שנקרא ACE2 הנמצא על גבי תאי המטרה.
מחקרים אחרונים פיענחו את המבנה של החלבון ומצאו שחלבון ה SPIKE כולל שני רכיבים : תת-יחידה S1 המכילה אזור שמזהה ונקשר לקולטן ACE2 שנמצא על פני התא המודבק; ותת-יחידה S2, המכילה מקטע שעוזר לנגיף להיכנס לתוך התא, על ידי כך שהקרום שעוטף אותו מתאחה עם קרום התא. לאחר ש-S1מבצע את פעולתו ונקשר לקולטן ACE2, חלבון ה-Spike נחתך, וכך נחשף אזור ה-S2, הפועל לאיחוי של קרום הנגיף עם קרום התא המודבק. לנגיף הקורונה יכולת הסתגלות למינים חדשים וזה נובע מהמבנה של חלבון ה SPIKE , באמצעות שינויים במבנה החלבון, הנגיף יכול להסתיר או לחשוף אזורים הנקשרים לתא שאליו הוא חודר . כאשר חודר הנגיף לתאי מערכת הנשימה באדם הוא גורם למחלת COVID 19 (מחלת הקורונה) המאופיינת בקשיי נשימה ושיעול ועלייה בחום הגוף .
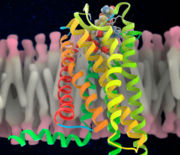
איור 2 חלבון ספייק נקשר על פני הקולטן של התא המודבק אילוסטרציה של מבנה הקולטן Ramon Andrade 3Dciencia, SPL
2)שחרור החומר הגנטי הוירוסי בתא המאכסן
נגיף הקורונה הוא נגיף מסוג RNA. כלומר הגנום שלו מורכב במולקולת RNA, ולא במולקולות DNA, כמו הגנום שלנו ושל כל בעלי החיים, הצמחים וגם החיידקים. כשבוע לאחר שהנגיף תועד לראשונה קבעו חוקרים את רצף ה- RNA שלו. בעוד שהגנום של האדם מורכב מלמעלה משלושה מיליארד "אותיות" או בסיסי DNA, הגנום של הנגיף מכיל פחות מ- 30,000 אותיות גנטיות ומספר קטן של גנים. לאחר שהנגיף נכנס לתוך התא, הוא משחרר קטע של חומר גנטי בצורת RNA.
3)הרכבת נגיפים חדשים
מכונות התא מתחילות לייצר בקצב מהיר עוד ועוד RNA נגיפי וחלבונים נגיפיים, ואלו מורכבים יחדיו ליצירת עותקים שלמים של הנגיף. העותקים החדשים נישאים לשוליים החיצוניים של התא, ויכולים לצאת ממנו במטרה להדביק תאים נוספים.
4)שחרור הנגיפים החדשים מהתא המאכסן
השלב האחרון של השכפול הויראלי הוא שחרור עותקי הנגיף החדשים המיוצרים בתא המארח. כל תא נגוע יכול לשחרר מיליוני עותקים של הנגיף לפני שהוא מתפרק לבסוף ומת. נגיפים מסוימים משתחררים כאשר התא המארח מת, ואילו נגיפים אחרים יכולים יכולים להשתחרר דרך קרום התא מבלי להרוג אותו ישירות. לאחר יציאת הנגיפים מהתא הנגוע, הם עשויים להדביק תאים סמוכים ולחזור על מחזור השכפול. שיעול והתעטשות עלולים להפיץ ליחה מלאה נגיפים מדרכי הנשימה על אנשים ומשטחים סמוכים, שם הנגיף יכול להישאר בעל יכולת הדבקה במשך מספר שעות עד מספר ימים.
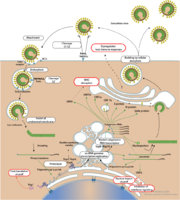
איור 3 מחזור החיים של נגיף הקורונה
פוטנציאל חלבון הספייק בפיתוח חיסונים ותרופות למחלה
הינו נגיף מתפרץ חדש אשר לא היה מוכר למדענים ולכן יש צורך בביצוע מחקר רחב על המבנה שלו ומיוחד על חלבוני המעטפת שלו , בנגף הספייק כבר ידוע אודות כלים טכנולוגים מתקדמים את הרצ הגנטי של הנגיף ואת מבנה חלבוני המעטפת שלו , אחד חלבוני המטרה שעליהם מתבסס פיתוח חיסון כנגד הקורונה הוא חלבון הספייק החיוני לחדירת הוירוס לתאים אם המדענים יפתחו חיסון כנגד חלבון הספייק הנגיף לא יוכל לחדור לתאים וגרום למחלה , חוקרים מגרמינה הראו שחלבון הספייק נצמד לחבון ACE2 שמתבטא על תאי מערכת הנשימה ובכך חודר לתאים , מנסים כעת לפתח חיסון שיפעיל תגובה חיסונית נגד חלבון הספייק שהוא אנטיגן אפשרי וכך לפגוע ביכולת של הנגיף לחדור לתאים[3].
כבר החל המירוץ לפיתוח חיסון נגד SARS-COV-2
פיתוח תרופות כנגד מחלת הקורונה יכולות להתבסס גם על חלבון הספייק , מציאת מנגנון הכניסה של הנגיף לתאים באמצעות חלבון S מאפשר לבצע סריקות למציאת מולקולות קטנות או תרופות קיימות שיכולות להפריע לכניסת הנגיף לתא. כך למשל, חברת APEIRON Biologics בוחנת יעילות של מולקולה קטנה בשם APN01 החוסמת את הקולטן של התאים שאליו נקשר חלבון S ובכך מונעת הדבקה. כרגע התרופה החדשה נבדקת בניסוי קליני שלב 1 לבטיחות ויעילות.[4].
רשימת מקורות
- ↑ Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang CL, Chen HD, Chen J, Luo Y, Guo H, Jiang RD, Liu MQ, Chen Y, Shen XR, Wang X, Zheng XS, Zhao K, Chen QJ, Deng F, Liu LL, Yan B, Zhan FX, Wang YY, Xiao GF, Shi ZL. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020 Mar;579(7798):270-273. doi: 10.1038/s41586-020-2012-7. Epub 2020 Feb, 3. PMID:32015507 doi:http://dx.doi.org/10.1038/s41586-020-2012-7
- ↑ Bar-On YM, Flamholz A, Phillips R, Milo R. SARS-CoV-2 (COVID-19) by the numbers. Elife. 2020 Apr 2;9. pii: 57309. doi: 10.7554/eLife.57309. PMID:32228860 doi:http://dx.doi.org/10.7554/eLife.57309
- ↑ Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A, Muller MA, Drosten C, Pohlmann S. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020 Apr 16;181(2):271-280.e8. doi: 10.1016/j.cell.2020.02.052. Epub 2020, Mar 5. PMID:32142651 doi:http://dx.doi.org/10.1016/j.cell.2020.02.052
- ↑ Zhang H, Penninger JM, Li Y, Zhong N, Slutsky AS. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med. 2020 Apr;46(4):586-590. doi: 10.1007/s00134-020-05985-9. Epub, 2020 Mar 3. PMID:32125455 doi:http://dx.doi.org/10.1007/s00134-020-05985-9



